Eki 2, 2012 | Aşı Efsanesi, SAĞLIK TERÖRİZMİ

Alan G. Phillips tarafından kaleme alınan “Dispelling Vaccination Myths: An Introduction to the Contradictions Between Medical Science and Immunization Policy” adlı makale, modern tıbbın kutsal ineği aşıların türeyiş ve yayılış efsanesindeki büyük gedikleri bilimsel çalışma ve referanslar desteğiyle tıkayan vurucu çalışmalardan yalnızca biri.
Phillips, çoğu anne-baba gibi aşıların herhangi bir risk taşıdığını bilmeden 2 aylık oğlunu aşılanması için kliniğe götürdüğünde, kendisine verilen aşı bilgi formunda bir bilgi dikkatini çekiyor. Formda, çocuğunun DPT (difteri-tetanoz-boğmaca) aşısı sonrası ciddi reaksiyon geçirme şansı 1750’de 1 olarak verilmişken, boğmaca geçirdiği takdirde bu hastalıktan ölme riskinin birkaç milyonda 1 olduğu yazıyor. Bunu klinikteki hekime işaret ettiğinde ise hekim kızgınlıkla böyle bir şey olamayacağını söyleyip odayı terkederken ağzından şu kelimeler dökülüyor: “Şu formu bir ara okumak gerekecek herhalde…” .
Bu deneyimden kısa bir süre sonra aşıdan kalıcı şekilde zarar görmüş bir çocukla ilgili haberleri de duyunca konuyu bizzat kendi araştırmaya karar veriyor ve bulgularını da herkesle paylaşmaya karar veriyor.
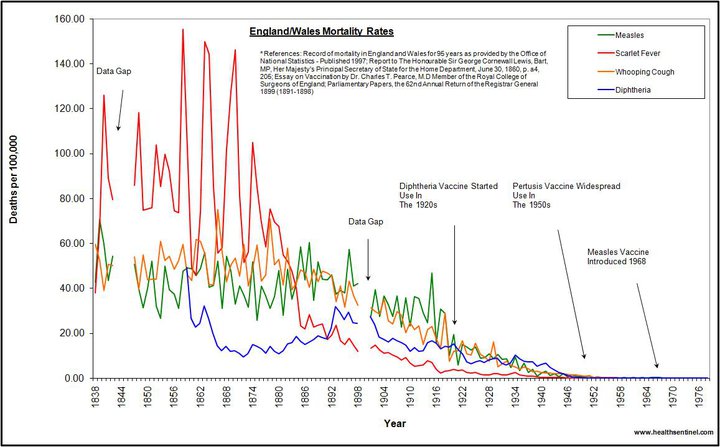
Sağlık yetkililerinden dünyanın her yerinde hastalıkların aşılar sayesinde azaldığını duyuyoruz ve doktorlar aşıların güvenle kullanılabileceği ve bizleri hastalıktan koruyacağı yönünde bizleri temin ediyor. Oysa Phlillips, tıpkı özel çabayla bu konuda mesai harcamış ve bilginin kaynağına giderek araştırma yapmış diğer sağlık uzmanları, ünlü hekimler ve sıradan vatandaşlar gibi, bu varsayımların devletin resmi istatistik kayıtları, yayımlanmış tıbbi çalışmalar, Amerikan Gıda ve İlaç Dairesi (FDA) ve Hastalıklarla Mücadele Merkezi (Centres for Disease Control/CDC) raporları ve dünyanın dört bir yanından saygıdeğer araştırmacı bilimadamlarının fikirleriyle doğrudan çeliştiğini tespit ediyor. Varsayımların aksine, bulaşıcı hastalıklar kitlesel aşılama kampanyaları uygulamaya konulmadan önceki onyıllar boyunca istikrarlı bir düşüş seyri izliyor, Amerika’daki doktorlar popülasyonda her sene yüzlerce ölüm ve kalıcı sakatlık da dahil olmak üzere binlerce ciddi aşı reaksiyonu rapor ediyor, bütün aşılarını olmuş topluluklarda salgınlar başgösteriyor ve araştırmacılar son birkaç onyılda çığ gibi artan düzinelerce kronik immün ve nörolojik hastalığı uygulanan kitlesel aşılama programlarına bağlıyorlar.
Dünyanın önde gelen tıp dergilerinde onyıllardır yayımlanmakta olan çalışmalarda aşıların işe yaramadığı vakalar ile ölüm de dahil olmak üzere aşılar sonucu oluşmuş ciddi yan etkilerin raporların olduğunu belirten Phillips, ayrıca hekimler, araştırmacı bilim adamları ve diğer bağımsız araştırmacılar tarafından kaleme alınmış düzinelerce kitapta, hakim bağışıklanma teorisi ve uygulamalarındaki ciddi hataların ortaya konmuş olduğunu söylüyor. Şaşırtıcı olan ise, tüm bunlara rağmen çocuk doktorları ve ebeveynlerin büyük kısmının bu bulgulardan habersiz olması. Ancak son zamanlarda tüm dünyada gerek anne-babalar gerekse sağlık çalışanları arasında sorunları fark eden ve zorunlu hale getirilen kitlesel aşılama kampanyalarını sorgulayanların sayısı gitgide artıyor. Artık uluslararası camiada zorunlu kitlesel aşılama aleyhtarı bir hareket oluşmuş durumda. Phillips’in bu raporu işte bu hareketin temelini oluşturan bilgilerden bir kısmını okuyucuya sunuyor.
Phillips’in gayesi insanlara aşı olun veya olmayın demekten ziyade, herkesin aşılanıp aşılanmama kararını vermeden önce gerçekleri neden incelemesi gerektiğine dair birkaç geçerli neden ortaya koymak. Yeni çocuk sahibi bir baba olarak, çocuk doktorlarını aşılanmanın riskleri hakkında tam manasıyla bilgi sahibi olmaya mecbur tutan herhangi bir mesleki etik ilkesi veya yasal zorunluluk olmaması ve aynı şekilde ebeveynlere aşılamanın çocukları için ölüm veya kalıcı sakatlık riskini de beraberinde getirdiğini bildirme zorunluluğu bulunmaması karşısında yaşadığı büyük şaşkınlığı paylaşıyor okurlarıyla. Aynı şekilde, her ne kadar iyi niyetli olursa olsunlar, eksik ve hatta bazı durumlarda tamamen yanlış bilgiye dayanan tıbbi girişimleri uygulayan hekim sayısının fazlalığına da işaret ediyor.
Phillips’in bu raporu konuya yalnızca kısa bir giriş – okuyucuyu konuyu şahsen araştırmaya ve derinine inmeye davet ediyor. Duygusal yoğunluğu bu kadar fazla ve şaibeli bir konuda objektif bir görüşe varabilmein tek yolu da bu.
Son olarak bir uyarısı var Phillips’in. Çoğu çocuk doktorunun bu konuya açık fikirli ve sakin bir tavırla yaklaş(a)madığını ve bunun belki de bu doktorların aidiyet ve mesleki itibarlarının aşıların varsayılan güvenilirlik ve etkinliği üzerine kurulu olmasından ve meslekleri icabı toplumda aşılanma oranlarını arttırmakla yükümlü olmalarından kaynaklandığını belirtiyor. Nedeni her ne olursa olsun, anekdotal olarak aktarılanın, doktorların kanıta rağmen aşıyla ilgili bir sorun olabileceğini kabul etmeye yanaşmadıklarıdır diyor. Kendi tecrübesinde örnekle, konuyu sakin bir şekilde açtığı ilk pediyatristin kendisine öfkeyle bağırmasını anımsatıyor ve aşı konusundaki yanılgıların kökünün çok derinlerde olduğunu söylüyor.
Yazıda ele alınan söylence başlıkları ise şu şekilde sıralanıyor:
Söylence 1: Aşılar güvenlidir …
Söylence 2: Aşıların koruyucu etkisi çok yüksektir …
Söylence 3: Bugün Amerika’da görülen düşük hastalık oranları aşılar sayesindedir …
Söylence 4: Aşılamanın temeli sağlam immünolojik teori ve uygulamalarına dayanır …
Söylence 5: Çocukluk çağı hastalıkları son derece tehlikelidir …
Söylence 6: Çocuk felci, aşılamanın tartışmasız en parlak başarı öykülerinden biridir …
Söylence 7: Çocuğum aşılara herhangi bir olumsuz reaksiyon geliştirmedi, o halde endişelenecek bir şey yok demektir …
Söylence 8: Hastalıkları önlemenin tek yolu aşılanmaktır …
Söylence 9: Aşı yaptırmak kanunen zorunludur ve aşıyı olmamak gibi bir seçenek yoktur …
Söylence 10: Halk sağlığı yetkilileri mutlak surette halkın sağlığını ve çıkarını gözetir …
Şimdi bunları teker teker, Phillips’in aktardığı şekliyle ele alalım..
Söylence 1:
“Aşılar güvenlidir…”
…mi acaba?
Federal hükümetin VAERS (Vaccine Adverse Events Reporting System; Türkiye’deki karşılığı “Aşı Sonrası İstenmeyen Etki İzleme (ASİE) Sistemi”dir) sistemi Amerikan Kongresi tarafından, 1986 yılında yürürlüğe giren Ulusal Çocuk Aşıları Tazminat Yasası uyarınca oluşturulmuştur. Bu sisteme her yıl ortalama 11,000 adet aşı sonrası yaşanan ciddi reaksiyon bildirimi yapılmaktadır; bildirilen ciddi reaksiyonlar arasında sayıları 100 ila 200’e ulaşan ölüm vakaları ile bunların birkaç katına ulaşan kalıcı sakatlık vakaları bulunmaktadır. VAERS yetkilileri, bildirilen istenmeyen etkilerin %15’ini “ciddi” yan etkilerin (acil servis başvurusu, hastane yatışı, ölümden dönme episodları, ömür boyu sakatlık oluşumu, ölüm) oluşturduğunu bildiriyor. VAERS bildirimlerinin bağımsız analizinde, Hepatit B aşısı için yapılan bildirimlerin %50’ye yakınının “ciddi” yan etki kategorisinde olduğu görülmüştür. Bu korkutucu oranlar ise buzdağının yalnızca görünen kısmıdır. FDA’nın tahminlerine göre aşı sonrası oluşan ciddi yan etkilerin ancak %1’i(3,4), CDC’nin açıklamasına göre ise bu tip olayların sadece %10’u bildirilmektedir(5). Hatta Kongre duruşmalarında alınan ifadelerde tıp öğrencilerine olası yan etkileri bildirmemeleri gerektiğinin söylendiği kayıtlara geçmiştir(6).
Aşılardan zarar görmüş ve/veya hayatını kaybetmiş çocukların anne-babalarının biraraya gelerek oluşturduğu Ulusal Aşı Bilgilendirme Merkezi’nin (National Vaccine Information Centre-NVIC) kendi yaptığı araştırma sonuçları şu şekildedir: “New York’taki her 40 sağlık merkezinden sadece 1’i aşı sonrası oluşan herhangi bir yan etki veya ölümü bildirdiklerini teyit etmiştir”. Başka bir deyişle, New York’ta aşıya bağlı ölüm veya mağduriyetlerin %97.5’i resmi olarak sisteme bildirilmemektedir. İşin tıp etiği ile ilgili kısmı bir yana (ki federal kanun doktorları ciddi yan etkileri bildirmeye yönlendirmektedir(7)), bu bulgular gerçek hayatta aşıya bağlı yaşanan ölüm ve ciddi yaralanmaların, bildirilen oranların 10 ila 100 katı üzerinde olabileceğini göstermektedir.
Pertussis’e (“boğmaca”) bakıldığında, aşıya bağlı ölüm sayısı yanında hastalığın kendisinden ölenlerin sayısı devede kulak kalmaktadır. CDC’ye göre boğmacadan ölenlerin sayısı uzun yıllar boyunca yılda 10 civarı seyretmiş ve hastalığın tepe yaptığı (boğmaca döngüsel olarak her 3-4 yılda bir başgöstermekte olup, aşılanma oranlarında böyle bir döngüsellik olmadığına göre hastalığın neden böylre bir seyir izlediğini kimse bilmemektedir) son yıllardan biri olan 1993’te sadece 8 ölüm kaydedilmiştir. Bildirim yapma oranının düşüklüğü hesaba katıldığında, aşısının hastalıktan 100 kat daha ölümcül olduğu kabul edilebilir. Bazıları aşıdan daha ölümcül olabilecek böyle bir bulaşıcı hastalığın geri dönmesini önlemek için bunun ödenmesi gereken bir bedel olduğunu öne sürmektedir. Ancak hastalıkta bu yüzyıl içinde görülen düşüşün büyük kısmının geniş aşılama kampanyalarından önce oluştuğu (boğmaca ölümlerinde %79’luk düşüş aşılardan önce gerçekleşmiştir), ve hastalığın görülme oranlarındaki düşüş eğiliminde kitlesel aşılama programına geçildikten sonra da hemen hemen hiçbir değişiklik olmadığı düşünülürse, bugün aşılara verilen zayiatların 0 boğmaca görülen bir toplum yaratmak için verilmesi gerekli ödünler olarak açıklanmaya çalışılması mantıken mümkün olmayacaktır.
Ne yazık ki, aşıya bağlı ölüm hikayesi burada da bitmemektedir. Çeşitli ülkelerde yapılan bilimsel çalışmalar aşılanmayı SIDS ölümlerinin nedenlerinden biri olarak ortaya koymuştur(8,9). SIDS (Sudden Infant Death Syndrome – Ani Bebek Ölümü Sendromu), ölümün spesifik nedeninin bilinmediği hemen her durumda kullanılabilecek bir teşhistir; Amerika’da her yıl 5,000 ila 10,000 SIDS ölümü yaşandığı tahmin edilmektedir. Yapılan bir çalışmada Amerika’daki SIDS ölümlerinin tepe noktası 2 ve 4. aylar olarak belirlenmiştir; 2. ve 4. aylar tam da bebeklere ilk iki rutin aşı grubunun verildiği aylardır(10). Yapılan bir diğer çalışmada da aşılamayı takip eden 3 haftayı içine alan dönem ile SIDS ölümleri arasında net bir korelasyon bulunmuştur. Yine yapılan bir başka çalışmada, Amerika’da her yıl aşılanmayı takip eden 4 gün içerisinde 3,000 çocuğun öldüğü tespit edilmiş (ancak şaşılacak şekilde çalışmayı yürüten bilimadamları SIDS ve aşılar arasında bağlantı olmadığına hükmetmiş), bir diğer araştırmacının çalışmasında da SIDS vakalarının en azından yarısının aşılardan kaynaklandığı sonucuna varılmıştır (11).
Aşılar ve SIDS ölümleri arasında nedensellik bağlantısı kuran bu ilk çalışmaların hemen ardından, ilişki olmadığı yönündeki bulgularıyla sponsorluğu aşı üreticisi firmalar tarafından yapılan çalışmalar birbirini izlemiş ve hatta bu çalışmalardan birinde aşılanan kişilerde SIDS ölümlerinin aşılanmayanlara göre biraz daha az görüldüğü iddia edilmiştir. Ne var ki sonradan yapılan bir başka bilisel çalışma(12) ile aşı sanayi destekli bu çalışmaların geçerliliği, çalışmalarda bulunan ‘karıştırıcı etken’lerin (confounding factors) sonuçları hatalı şekilde aşıdan yana bulgular ortaya konmasına neden olacak şekilde çarpıttığı gerekçesiyle sorgulanmıştır. Bu durumda, ortada ancak birbiriyle çelişen kanıtlar bulunduğundan sözedilebilir. Peki ama sağlık konusunda ihtiyatı elden bırakmamaya çalışmamız gerekmez mi? Aşılar ve bebek ölümleri arasında bulunmuş güvenilir bir korelasyon ilişkisi, kaydedilen tüm SIDS ölümlerinin aşılanma durumunun titizlikle araştırılmasını gerektirmez mi? Oysa sağlık yetkilileri ihitiyatlı davranmak yerine kategorik ret ve inkar yolunu seçmişlerdir.
1970’lerin ortasında Japonya aşılanmaya başlama yaşını 2. aydan 2. yıla çıkartıyor ve ülkedeki SIDS ölümlerinde ani bir düşüş yaşanıyor(13); Japonya dünya ülkeleri arasındaki bebek ölümleri sıralamasında 17.’likten birden 1. sıraya çıkıyor (yani, bebeklere aşı uygulanmadığı dönemde Japonya dünyada en az bebek ölümü yaşanan ülke oluyor). İngiltere’de, aşıya bağlı beyin zedelenmesi vakalarının medyaya yansımasının ardından geçici bir süreliğine aşılanma oranları %30’lara geriliyor. Bebek ölüm oranları yaklaşık 2 sene boyunca hızlı bir düşüş gösteriyor, ancak 1970’lerin sonunda aşılanma oranlarının yeniden yükselişe geçmesiyle baraber bebek ölümleri de yeniden artıyor. Bu yaşananlara rağmen, tıp camiası inkarcı duruşunu değiştirmiyor. Koronerler SIDS kurbanlarının aşılanma durumlarına bakmıyor, ölümlerin acısı aşıların içerdiği tehlikeler konusunda hiçbir şey bilmeyen, ‘aydınlatılmış onam’ hakkından yararlandırılmamış ebeveynlerden çıkartılıyor.
FDA ve CDC’nin aşıların istenmeyen etki raporlamasındaki eksiklikler ile ilgili kendi açıklamalarına bakılacak olursa, aşıya bağlı istenmeyen etkilerin toplam sayısının yılda 100,000 ila 1 milyon vakayı bulduğu söylenebilir, kaldı ki bunların %20’sinin de “ciddi yan etkiler” olduğu düşünülmelidir. Bu sorun, yapılan bir çalışmada(14) DPT (difteri-boğmaca-tetanoz) aşı serisini tamamlayan her 175 çocukta 1’inin “ağır reaksiyon” geçirdiğinin bulunması ve ayrıca avukata verilen bir doktor raporunda(15) her 300 DPT aşılamasında bir nöbet vakası yaşanmış olduğu gerçekleriyle de vurgulanmaktadır.
Aslına bakılacak olursa, İngiltere’de 1970’lerin ortasında aşılama oranlarının %30’a düşmesiyle birlikte boğmaca ölümlerinde de düşüş yaşanmıştır. İsveçli epidemiyoloji uzmanı B. Trollfors’un boğmaca aşısının koruyucu etkisi ve toksisitesi üzerine dünya çapında yaptığı araştırmada, “boğmaca ölüm oranları şu anda sanayileşmiş ülkelerde oldukça düşük seyretmekte olup, yüksek-düşük ve 0 aşılama oranlarına sahip ülkeler karşılaştırıldığında ölüm oranlarında herhangi bir fark saptanamamıştır.” bulgusu ortaya çıkmaktadır. Aynı araştırmada ayrıca İngiltere, Galler ve Batı Almanya’da, aşılanma oranlarının yüksek olduğu 1970 senesinde, oranların düştüğü 1980 senesinin ikinci yarısına göre daha fazla boğmaca ölümü yaşandığı tespit edilmiş(16).
Aşılar sadece çocuklarımızın sağlığı ve yaşamlarına mal olmuyor. Amerikan Federal Hükümeti’nin NVICP adıyla bilinen Ulusal Aşı Mağduriyeti Tazminat programı (National Vaccine Injury Compensation Program) çerçevesinde, kurulduğu 1988 yılından beri çocukları aşılardan zarar görmüş veya ölmüş ailelere 1,2 milyar doların üzerinde tazminat ödenmiştir(17). Bu tazminatlar için gerekli para ise, doğrudan aşıyı olan halkın aşı için ödediği vergilerden tahsil edilmektedir. Aşı mağdurları tazminatlarını kendi ceplerinden öderken, diğer yandan ilaç şirketleri ‘esir’ bir pazarı kendilerine yasa yoluyla bağlamış durumdalar; Amerika’da 50 eyalette de aşılar kanunen mecbur tutulmaktadır (ancak çoğu eyalette aşı olmamanın yasal yolları da mevcut, bunun için bkz. ‘Söylence 9’). Hal böyleyken, aynı ilaç firmalarına, ürettikleri aşıların doğurduğu olumsuz sonuçlara karşı “yasal bağışıklık” kazandırılmış, borç yükümlülüğünden muaf tutulmuşlardır. Ayrıca, ilaç firmalarının [Amerikan hukuk sisteminde mevcut “gag order” kararları ile] mahkeme davalarının içeriği üzerinde yayın(lama) yasağı hakkı kullanmalarına izin verilmiş, böylelikle aşıya bağlı mağduriyetler için açılmış davalarda geçen aşının zararları ile ilgili bilgilerin kamuoyu tarafından duyulması engellenmeye çalışılmıştır. Bu tip düzenlemeler açıkça ahlak dışıdır; habersiz bırakılmış Amerikan toplumu bu yolla aşı şirketlerinin hukuki mesuliyetlerinden doğan borcunu ödemeye zorlanmakta, bu yapılırken de aynı halkın ürünlerinin zararları hakkında bilgi edinmekten kesin bir şekilde alıkonulması sağlanmış olmaktadır. Bu düzenleme ayrıca ilaç firmalarının daha güvenli aşılar üretmesini sağlayacak herhangi bir teşviği de ortadan kaldırmaktadır; sonuçta, aşıları ölüm veya hasara yol açsa dahi herhangi cezai bir yaptırım olmayacağı belli ve üstüne, bu aşılardan elde ettikleri kar da yanlarına kalacak.
Bu noktada, sigorta şirketlerinin, ki en iyi borçlar hukuku çalışmalarını onlar yapmaktadır, aşı reaksiyonlarını kapsam dahiline almayı reddettiklerini belirtmemiz gerekiyor. Bu konuda hem ilaç ve ecza şirketleri hem de sigorta şirketlerinin pozisyonu bell ki ‘kar hesabı’ üzerinden belirleniyor.
AŞI GERÇEĞİ 1
“Aşılama, bilgi edinme şansı tanınmamış aileleri inanılmaz bir maddi ve manevi yük altına sokan, sayıları ciddi boyutta ölüm ve sakatlıklara neden olmaktadır.”
Referanslar:
1.Vaccine Adverse Events Reporting System (VAERS); National Technical Information Service, Springfield, VA 22161, 703-487-4650, 703-487-4600; see also NVIC, infra note 7; and the VAERS website athttp://www.fda.gov/cber/vaers/vaers.htm
2.Statement of the National Vaccine Information Center (NVIC), Hearing of the House Subcommittee on Criminal Justice, Drug Policy and Human Resources, “Compensating Vaccine Injuries: Are Reforms Needed?” September 28, 1999.
3.Less than 1%, according to Barbara Fisher, citing former FDA Commissioner David Kessler, 1993, JAMA, in the Statement of the NVIC, supra note 2.
4.Less than 10%, according to KM Severyn, R.Ph., Ph.D. in the Dayton Daily News, May 28, 1993. (Vaccine Policy Institute, 251 Ridgeway Dr., Dayton, OH 45459)
5.American Association of Physicians and Surgeons, Fact Sheet on Mandatory Vaccines athttp://www.aapsonline.org/
6.Jane Orient, M.D., Director of the American Association of Physicians and Surgeons, “Mandating Vaccines: Government Practicing Medicine Without a License?” 1999.
http://www.haciendapub.com/article25.html7. 42 U.S.C.S. § 300aa-25(b)(1)(A),(B).
8. Karlsson L. Scheibner V. Association between non-specific stress syndrome, DPT injections and cot death. Paper presented to the 2
nd immunization conference, Canberra, Australia, May 27-29, 1992
http://www.whale.to/vaccines/cot_death.html . See also Viera Schiebner, Ph.D.,
Vaccination: 100 Years of Orthodox Research Shows that Vaccines Represent a Medical Assault on the Immune System for discussion and references.
9. W.C. Torch, “Diptheria-pertussis-tetanus (DPT) immunization: A potential cause of the sudden infant death syndrome (SIDS),” (Amer. Academy of Neurology, 34th Annual Meeting, Apr 25 – May 1, 1982), Neurology 32(4), pt. 2.
10. Id.
11.Viera Schiebner, Ph.D., Vaccination: 100 Years of Orthodox Research Shows that Vaccines Represent a Medical Assault on the Immune System, 1993.
12. Confounding in studies of adverse reactions to vaccines [see comments]. Fine PE, Chen RT, REVIEW ARTICLE: 38 REFS. Comment in: Am J Epidemiol 1994 Jan 15;139(2):229-30. Division of Immunization, Centers for Disease Control, Atlanta, GA 30333.
13. See Viera Scheibner, supra note 12.
14. Nature and Rates of Adverse Reactions Associated with DTP and DT Immunizations in Infants and Children (Pediatrics, Nov. 1981, Vol. 68, No. 5)
15. DPT Report, The Fresno Bee, Community Relations, 1626 E. Street, Fresno, CA 93786, December 5, 1984.http://www.whale.to/vaccines/fresno.html
16. Trollfors B, Rabo, E. 1981. Whooping cough in adults. British Medical Journal (September 12), 696-97.
17. National Vaccine Injury Compensation Program (NVICP) http://bhpr.hrsa.gov/vicp/
.

Eyl 27, 2012 | SAĞLIK TERÖRİZMİ
Aşılar o kadar hayatımızın bir parçası haline gelmiş ki, Katoliklerin çocukları vaftiz etmesi gibi ritüelleşmiş veya günlük temel ihtiyaçlardan peynir ekmek yemek gibi adeta hayatn ayrılmaz bir parçası, normalimiz olmuş, bir ikinci defa da üzerine düşünmemişiz. Niye düşüneceğiz ki, aşılar güvenlidir ve hastalıklardan korur, değil mi?
Hayır. Aşılar tüm bireylerde güvenle kullanılacak tıbbi ilaçlar değildir ve günümüz immünoloji dalının üzerine inşa edildiği “aşılama yoluyla yapay bağışıklanma” gerçek bağışıklanma ve hastalıktan korunma değildir.
Ortodoks tıbbın savı nedir? – Aşılar güvenlidir.
İşin aslı, devlet yetkilileri ve ilaç/ecza sanayisinin bu iddiaların aksine, aşıların diğer ilaç veya prosedürler için standart olan plasebo kontrollü araştırmalara tabi tutulmamış ve bu araştırmalar sonucunda güvenli ilan edilmemiş olduğudur. Plasebo kontrollü bir çalışmada bir ilaç uygulamasının güvenli olmadığı, örneğin şeker tableti gibi nötr bir maddeyle karşılaştırılarak tespit edilir. Aşıların güvenlik denetlerinde ise, yeni aşı öyle etkisiz bir maddeyle (örn. steril salin su) karşılaştırılmıyor. Aşı deneylerinin etkisiz maddesi, plasebosu, “güvenlik profili bilinen” bir başka aşı oluyor. Deney aşamasındaki yeni aşının oluşturduğu yan etki sayısı, plasebo olarak kullanılan aşının oluşturduğu reaksiyon sayısıyla aynıysa, aşı üreticileri yeni aşıyı plasebo kadar güvenli ilan ediyorlar. Evet doğru, yeni aşı bu durumda eski aşı kadar güvenli olmuş oluyor ama bu aşının gerçek plasebo, yani etkisiz bir madde kadar güvenli olduğu anlamına gelmiyor.
Demek ki,
İlke 1: Aşı güvenlik çalışmalarında plasebo eski bir aşı olacak!
İlke 2: Yeni aşının güvenli olduğunun ispatı için gerekirse işimize gelmeyen veriyi saymayacağız!
Örnek Üzerinden Açıklama:
Haemophilus influenza (HiB) ve Hepatit B aşılarını birleştirerek tek bir aşı haline getiren Merck‘ün Comvax marka Hib-HB karma aşısının güvenliğini tespit etmeye çalışan klinik deneye bakıyoruz. Bu deney yukarıdaki 2 ilkenin uygulamaya geçmiş hali; plasebomuz tekli olarak verilen HiB ve Hep-B aşıları, ortaya çıkan negatif bulgular ise tabii çalışmadan çıkartılıyor.
İdeal olarak aşıyı uygulayacak doktor veya hemşirenin ne yapması lazım mesela? Pub-Med’e girip, aşıyla ilgili bu güvenlik çalışmasının sadece özetini değil, ana gövdesini ve metodolojisini de kontrol etmesi, aşağıda alıntılanan kısımla ilgili sorunları değerlendirip, kendisine çocuğunu getiren anne-babayı bu konuda eksizsiz bilgilendirmesi ve uyarması, değil mi? İdeal olanla gerçekte olanlar arasındaki 7 farkı bulunuz..
Der ki çalışmada [vurgular bana aittir],
“During the study, 17 children (1.9%) had an event within 14 days of vaccination that met one of the defining criteria of a serious adverse experience. These experiences included seizure, asthma, diarrhea, apnea (stopped breathing) and several others. Virtually all of these adverse experiences were classified as serious because they involved a hospitalization. None were judged by the study investigators to be caused by Comvax or the placebo, the two vaccines given separately. In addition, three deaths among participants in this study were attributed to sudden infant death syndrome [SIDS] that occurred more than 14 days after administration of a dose of vaccine (on days 29, 31, and 38, respectively). Again, none of the deaths were judged by the investigators to be related to vaccination.” (REF: “Safety and immunogenicity of a bivalent Haemophilus influenzae type b/hepatitis B vaccine in healthy infants. Hib-HB Vaccine Study Group.” http://www.ncbi.nlm.nih.gov/pubmed/9194110)
Görüldüğü üzere kalemini oynatıverirsen ölümleri aşıyla alakasız kılabilir (niye çünkü 14 gün içinde olmamış; yani 15. gün ölse çocuk aşıyla alakası olmayacak?!), SIDS diye nedeni bilinmez(!) [ama tek bilinen var ki o da aşıyla alakası olmadığı bu ölümlerin; çünkü ilke nedir, aşılar güvenlidir!] ölümlerle dolu koca bir kategoriye bu çocukları istatistiksel değer olarak gömebilir, karma aşının yan etkileri tekli aşılarınkiyle benzer diye Comvax’ı “plasebo kadar güvenli” ilan edebilir ve bu güzelim pırıl pırıl karma aşıyı artık “güvenli ve gayet iyi tolere edilebilen” bir aşı ilan edip dünyaya pazarlayabilirsiniz! Üstelik de bakın ne kadar ekonomik, çocuklar teklileriyle 6 defa aşılanacaklarına 3 defada hallediyoruz, daha ne isteriz?
İlke 3: Güvenlik çalışmaları genel toplumu temsil gücü zayıf, az sayıda ancak tamamen sağlıklı bebek ve çocuklar üzerinde yapılacak!
Açıklama: Çalışmalar sayıları birkaç bini geçmeyecek çocuklar üzerinde yapılıyor. Herhangi bir nörolojik bozukluğu olan, daha önce nöbet geçirmiş, astımlı, egzemalı veya immün sistemi baskılanmış çocuklar bu çalışmalara alınmıyor. Yani, örneğin Amerika için düşünecek olursanız bebek ve çocuk popülasyonunun yaklaşık %60’ının herhangi bir aşı güvenlik deneyine alınması sözkonusu değil. Oysa, aşı onayı aldıktan sonra bilindiği gibi tüm çocuklara öneriliyor; bunların arasında kronik hastalığı olanlar, prematüreler veya nörolojik rahatsızlıkları olanlar olduğu gibi pazarlama öncesi çalışmalarda denenmemiş popülasyonlar (farklı yaş, etnisite) da yer almakta. Sağlık durumu güvenlik deneyine katılamayacak denli riskteyse, aynı çocukların bu mantıkla çıktıktan sonra aşının kendisini de olmaması gerekir.
İlke 4: Deneylerde yan etki izlemesi sadece 4 ila 15 gün’le sınırlı tutulacak!
Açıklama: Aşıya bağlı otoimmün rahatsızlıkların ortaya çıkması aylar hatta bazen yıllar sürebilir. Aşılamadan sonraki iki hafta içinde değil de bir iki gün sonra oluşuyorsa reaksiyon, bunun aşıyla bağlantısı olmadığına hükmediliyor, kaldı ki bağlantılı olduğunu ispat etmek de oldukça güç olduğundan aşıları değil ama aşı üreticilerinin kendileri bu bakımdan oldukça emniyetli bir konumdalar.
İlke 5: Aşıların toksisite çalışmaları yapılmayacak!
Açıklama: Aşılar önce hayvanlar üzerinde test ediliyor, ancak aşıların halihazırda güvenli oldukları varsayıldığından hayvanlarda yapılan ön çalışmalarda toksik etkileri olup olmadığına bakılmıyor.
Bu konuyla ilgili olarak FDA/CDC (Amerikan Gıda ve İlaç Dairesi/Hastalıklarla Mücadele Merkezi) toplantısında (2002) sağlık yetkillerinin görüşmelerini okuyabilirsiniz(1).
Bu toplantıda geçen ifade aynen şu şekildedir:
“Historically, the non-clinical safety assessment for preventive vaccines has often not included toxicity studies in animal models. This is because vaccines have not been viewed as inherently toxic, and vaccines are generally administered in limited dosages over months or even years.”
Amerika’da ve diğer gelişmiş ülkelerde bebeklerin bir ziyarette oldukları aşı sayısının 9 hatta 11’i bulduğu bilinmektedir. Karma aşıların her birinin 3’erli veya 5’erli aşılar olduğu unutulmamalıdır. Aşılar içinde kullanılan thimerosal ve aluminyum gibi ağır metallerin bu bir günde 9’lu aşı uygulamalarında ulaştığı toplam değerler, bebeklerin kilolarına oranlandığında çoğu için akut ağır metal zehirlenmesi anlamına geldiği göz ardı edilmemelidir.
Aşı prospektüslerinden alınmış bilgilere bakalım, güvenlik deneylerinde altın ilkelere uyulmuş mu?
Hepatit B
Energix B (Hep B) Glaxo Smith Kline
Kontrol grubuna plazmadan elde edilmiş aşıların verildiğinden bahsediyor, ancak bunların tam olarak hangi aşılar olduğunu bilmiyoruz.
“Ten double-blind studies involving 2,252 subjects showed no significant difference in the frequency or severity of adverse experiences between ENGERIX-B and plasma-derived vaccines.”
Yani, 2,252 kişi üzerinde yapılan 10 çift kör çalışma, ENGERIX-B aşısı ile plazma kökenli aşılar arasında istenmeyen etki görülme sıklığı veya bu reaksiyonların ağırlığı bakımından kaydadeğer bir fark göstermemiş. İlke 1 başarıyla uygulanmış.
“In 36 clinical studies, a total of 13,495 doses of ENGERIX-B were administered to 5,071 healthy adults and children who were initially seronegative for hepatitis B markers, and healthy neonates. All subjects were monitored for 4 days post-administration.”
Yani, yapılan 36 klinik çalışmada, Hepatit B antikorları taşımayan sağlıklı yetişkin, çocuk ve yenidoğanlardan oluşan 5,071 kişiye toplam 13,495 doz ENGERIX-B aşısı yapılmış ve ne kadar süreyle izlenmiş dersiniz bu insanlar yan etki için? Koskoca bir 4 gün! Yıldızlı bir İlke 4 uygulaması!
Recombivax HB (Hep B) Merck
Bu aşının güvenlik çalışmalarında kontrol grubu kullanılMAmış.
“In three clinical studies, 434 doses of RECOMBIVAX HB, 5 mcg, were administered to 147 healthy infants and children (up to 10 years of age) who were monitored for 5 days after each dose.”
– Yapılan 3 klinik çalışmada 147 sağlıklı [İlke 3] bebek ve (10 yaşa kadar) çocuğa 434 doz 5mcg’lık RECOMBIVAX HB uygulanmış. Çocuklar her doz sonrası 5 gün izlenmiş. [İlke 4]
“In a study that compared the three-dose regimen (5 mcg) with the two-dose regimen (10 mcg) of RECOMBIVAX HB in adolescents, the overall frequency of adverse reactions was generally similar.”
– Ergenlerde RECOMBIVAX HB’nin 3 doz (5 mcg) uygulama yöntemini 2 dozluk (10 mcg) olanla karşılaştırdıklarında, aşı sonrası istenmeyen etkilerin oluşma frekansı genel olarak benzer çıkmış. [ilkelerin ilkesi, İlke 1]
“In a group of studies, 3258 doses of RECOMBIVAX HB, 10 mcg, were administered to 1252 healthy adults who were monitored for 5 days after each dose”
– Yapılan bir grup çalışmada, 1252 sağlıklı [İlke 3] yetişkine 3258 doz 10 mcg’lık RECOMBIVAX HB aşısı uygulaması yapılmış ve tabii ne kadar izlenmişler yan etki oluşumu için? Her dozdan sonra tam tamına 5 gün! [İlke 4]
Şimdi düşünelim tekrar, Hepatit B aşılarımız neden güvenliymiş? Çünkü 3 doz aşı olanlara 5’er gün boyunca bakmışlar, 2 doz olanlarla aşağı yukarı aynı reaksiyonların olduğunu görüp 6. gün tamam o zaman biz bunu milyonlarca bebeğe ve yetişkine böylece verebiliriz demişler. Veyahut da, pek gizemli bir plazma kökenli aşıyla karşılaştırıldığında benzer yan etkileri veriyor, o halde güvenlidir buyrulmuş.
Bu aşılar sonrasında gözlemlenen sistemik ve/veya ciddi yan etkileri verilen linklerden görebilirsiniz.
DTaP [diphtheria-tetanus-acellular pertussis] / Difteri-Tetanoz-Boğmaca
Tripedia (DTaP) Sanofi Pasteur:
Bir gruba Tripedia, diğer kontrol grubuna da Aventis’in tam hücre DTP aşısı veriliyor (bkz. prospektüs 6. sayfa).
Amerika’da yapılan çift kör, karşılaştırmalı deneyde 673 bebek rastgele seçilmek suretiyle 3 doz Tripedia veya AvP’nin tam hücre DTP’sini oluyorlar (Tablo 2).
Tripedia alan 505, tam hücre boğmaca aşısı DTP alan 167 bebek de dahil olmak üzere toplam 672 bebekten güvenlik verileri elde ediliyor. 3 doz alımından sonra bildirilen bölgesel reaksiyonlar (38 derecenin üstünde ateş, huzursuzluk, baş dönmesi ve anoreksiyanın) Tripedia kullanılanlarda önemli derecede az çıkmış.
Reaksiyon oranlarının tepe noktası ilk 24 saatmiş, sonraki 2 gün içinde ise önemli derecede azalma görülüyormuş.
İstenmeyen etkilerde benzer bir düşüş yine Tripedia aşısı ile Lederle Laboratories’in tam hücre boğmaca DTP aşısının karşılaştırıldığı, Amerikan NIH (National Institute of Health) tarafından yaptırılan randomize kontrollü çift kör bir çalışmada da görülmüş.
DTaP, DTP’nin aselüler versiyonudur. Uzun yıllar boyunca kullanılan bu tam hücre aşılar son derece reaktif olduğundan değiştirilmek zorunda kalınmıştır. Yapılan bu çalışmalar DTaP aşısının yerini aldığı DTP aşısı kadar reaktif olmadığını göstermiş, umuyoruz ki öyledir. Ancak yine de, anne-baba olarak düşünün: sizce bu veriler yeni DTaP aşısının çocuğunuz için güvenli olduğunu kanıtlıyor mu?
Infanrix (DTaP) Glaxo Smith Kline:
Ürün prospektüsünden gördüğümüz kadarıyla yapılan güvenlik çalışmalarında kontrol gruplarına yine tam hücre DTP veriliyor veya kontrol grubu kullanılmıyor!
HPV
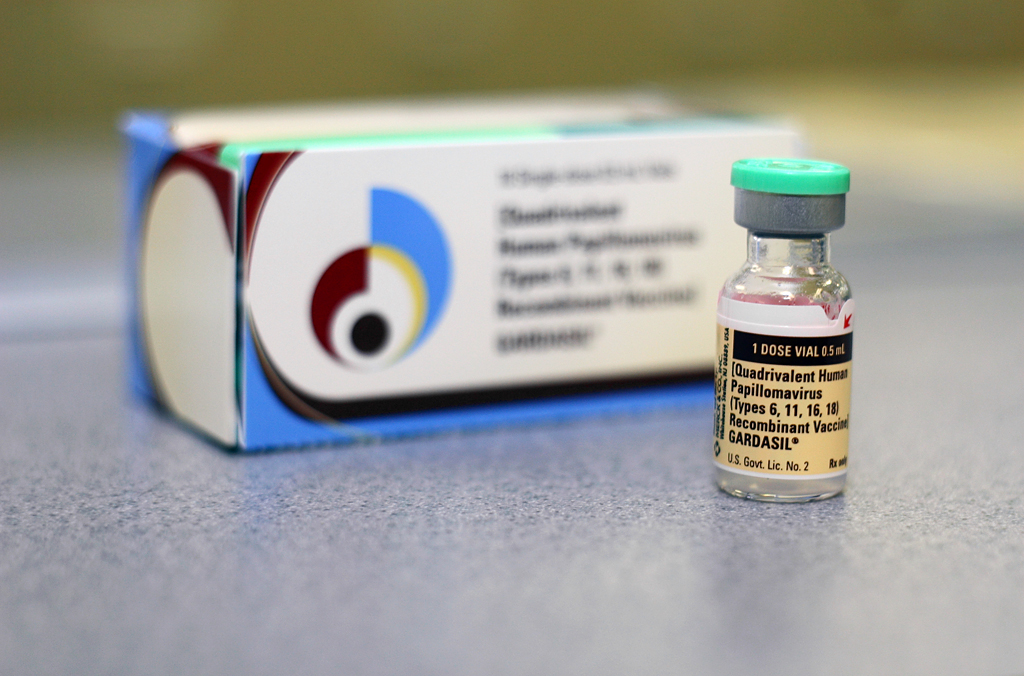
Gardasil (HPV) Merck:
Gardasil grubunda 5,088 denek var. Bu sayı neden mi önemli? Bakalım..
İlk kontrol grubuna (3,470 kişi) aluminyumlu bir placebo veriliyor. İkinci grup (sadece 320 kişi) salin plasebo alıyor.
Şimdi, Merck hafif yan etki karşılaştırması yaparken her iki plasebo grubundaki verileri birbiriyle karşılaştırıyor; yani hangilerinin salin grubunda hangilerinin aluminyum grubunda oluştuğu belli. Ancak iş ciddi yan etkilerin karşılaştırılmasına geldiğinde Merck bu defa iki plasebo grubunu birleştiriyor ve sonra tutup bunu Gardasil alan grupla karşılaştırıyor. Aluminyum ve salin gruplarındaki ağır yan etki farklarını göstermiyorlar bize.
Peki bu niye önemli? Aluminyum içeren plasebo grubundaki yan etkiler salin grubuna oranla anlamlı derecede fazla çıksa bu bize neyi kanıtlar ve hatta aluminyum grubunda elde edilen değerler Gardasil grubundakiyle istatistiksel manada benzer çıksa ne düşünmemiz gerekir? Gardasil’in içeriğindeki temel maddelerden biri nedir? Aluminyum olmasın?!
Çocuk Felci [Polio]
IPOL (Inactivated Polio) Sanofi Pasteur
İnaktive çocuk felci aşısının deneylerde (en reaktif aşılardan) DTP ile birlikte verildiğini görüyoruz. Bebeğin başka bir yerinden ancak DTP ile aynı anda verilen IPV için deney sonucunda hangi sistemik reaksiyonun hangi aşıya bağlı olduğunu kestiremedik, ancak oluşan bu sistemik reaksiyonlar DTP tek başına vurulduğunda yaşanan reaksiyon görülme frekansıyla aşağı yukarı aynı gözüküyordu, eh o halde IPV güvenlidir, hatta DTP gibi başka aşılarla verilmesi de caizdir hükmüne varılmış.
MMRII (Measles, Mumps, Rubella) / [Kızamık, Kabakulak, Kızamıkçık (KKK) canlı vürüs aşısı]
MMR II Merck
Kontrol grubuna tek veya çift valanlı kızamık, kabakulak veya kızamıkçık aşısı veriliyor.
Temel olarak yapılan şey, aşıyı kendisiyle karşılaştırmak yani. Mesela A grubu MMRII oluyor, kontrol grubuna da kızamık, kabakulak veya kızamıkçık tekli aşılarından biri vuruluyor veya bu tekli aşılardan ikisini birlikte vuruyorlar.
Konjüge Pnömokok Aşı
Prevnar 13 (Wyeth)
4,729 bebek ve 5 yaş altı çocuk üzerinde yapılan deneylerde Prevnar 13, Prevnar 7 ile karşılaştırılıyor, lokal ve sistemik reaksiyonlar için anne-babalar 7 gün izleme yapıyor. Ayrıca Prevnar 13 dozları, çocukların yaşadığı ülkenin aşı takvimine uygun şekilde diğer aşılar ile de eşzamanlı olarak veriliyor.
Sonuç: “Overall, the safety data show a similar proportion of Prevnar 13 and Prevnar subjects reporting serious adverse events. Among US study subjects, a similar proportion of Prevnar 13 and Prevnar recipients reported solicited local and systemic adverse reactions as well as unsolicited adverse events.”
Peki, 13 valanlı Prevnar’ın karşılaştırıldığı 7 valanlı Prevnar’ın güvenlik çalışmalarına gittiğimizde nelerle karşılaşıyoruz?
CDC’ye bağlı çalışan Amerikan Aşı Danışma Kurulu’nun (ACIP) Prevnar’ın güvenliği ile ilgili açıklamalarına bakalım (http://www.cdc.gov/mmwr/PDF/rr/rr4909.pdf, sayfa 15).
2., 4., 6. aylar ile 12-15. aylar arasında vurulan PCV7’ye ilişkin yan etki tip ve oranları, aşılanmanın getirdiği faydalara bakıldığında kabul edilir düzeydedir. Kuzey Kaliforniya Kaiser Permanente aşı etkinlik deneyinde, PCV7 alanlar ile kontrol aşısını (araştırma aşamasındaki [“investigational”] Konjüge meningokok C aşı grubu) olanlardaki aşıya reaksiyon oranları karşılaştırılmıştır. PCV7 ve kontrol aşıları ile birlikte rutin çocukluk çağı aşıları da deneklere uygulanmıştır.* Aşı güvenliği değerlendirmesinde, lokal ve sistemik aşı reaksiyonları için her aşı dozu sonrası 48 ila 72 saat içinde gözlemlenenler ile 14 gün sonunda ortaya çıkanlar kullanılmıştır. Telefon görüşmesi yapılarak çalışma popülasyonun her iki altgrubundan istenmeyen etki öyküsü alınmıştır – başlangıçta DTwP alan grup (N=6,000) ve daha sonra DTaP aşısı alan bir grup (N=1,500). Aşılanma sonrası tıbbi müdahale gerektiren olağandışı olayların, ilk 30 gün içinde oluşan acil servis ziyareti ve ayakta tedavi konsültasyonları ve aşılanma sonrası 60 gün içinde oluşan hastane yatışları da dahil olmak üzere tüm çalışma kohortu için değerlendirilmesi yapılmıştır.
*Başlangıçta, çalışmada yer alan tüm çocuklar tam hücre boğmaca aşısı ve oral çocuk felci aşısını olmuşlardır; ancak çalışmanın yarısına gelindiğinde çocuklara uygulanacak aşı tavsiyesinde değişiklik olduğundan katılımcılara difteri toksoidi-tetanoz toksoidi-aselüler boğmaca aşısı [DTaP] ile inaktive çocuk felci aşısı [IPV] verilmeye başlanmıştır.
FDA’in aşı lisanslama dokümanlarına bakıldığında, Prevnar’ın DTaP veya Hib aşısı ile karşılarştırıldığı birkaç oldukça küçük ölçekli deney görülmekte; bu çalışmalardan birinde Hib grubu 80 bebekten oluşuyor.
Sayfa 26’da FDA der ki, “lokal ve sistemik reaksiyonlar ile diğer istenmeyen etkileri içeren aşı güvenlik verileri NCKP Etkinlik çalışmasından gelmektedir.”
Yani, Prevnar’ın güvenilirliğiyle ilgili bilginin çoğu yeni bir aşının bir başka deneysel aşı, “investigational group C meningococcal conjugate” ile karşılaştırıldığı tek bir deneyden geliyor! Ne kadar güvende hissettim kendimi ve çocuğumu, kelimelerle ifade edemiyorum?!
Dünya Tıp Birliği Helsinki Bildirgesi‘nin Tıbbi Bakımla Birleşik Tıbbi Araştırmalara İlişkin Ek İlkeler’inden 32.sine bakalım:
32. Yeni bir yöntemin yararları, riskleri, rahatsızlık ve etkilerinin aşağıdaki durumlar hariç olmak üzere kullanılmakta olan en iyi yöntemle karşılaştırarak denenmesi gerekir.
1. Mevcut kanıtlanmış tedavinin olmadığı durumlarda plasebo veya tedavi yapılmaması kabul edilebilir; veya
2. İkna edici ve bilimsel olarak geçerli nedenlerden ötürü bir yöntemin etkinliği veya güvenliliğini tespit etmek için plasebo kullanımının gerekli olması ve plasebo alan veya tedavi edilmeyen hastaların herhangi bir ciddi veya geri dönüşü olmayan zarara uğrama riski olmaması. Bu seçeneğin istismar edilmesinden kaçınmak için büyük dikkat sarf edilmelidir.
Peki deneysel bir aşı nasıl olur da etkinliği ve güvenliği kanıtlanmış(!) mevcut en iyi yöntem olabilir? Kanıtlanmış mevcut bir tedavi yoksa niye gerçek bir plasebo kullanılmaz?
Bu bölümde ele alınan aşı güvenlik çalışması örnekleri sanıyoruz ki Rotavirüsü aşısı patenti sahibi, Amerikan ACIP (aşı danışma kurulu) kurulunda üyelik yapmış endüstri sözcüsü pediyatrik immünolog Sn Paul Offit’in, “aşı karşıtı” ilan edip savaş açtığı aşıların güvenliğini sorgulayan topluluğa yönelik olarak yaptığı şu açıklama sanırız bu bağlamda yerini tam olarak buluyor:
“If they were willing to look at all the studies that were done with vaccines, they would find that they are, I think without question, the safest, best-tested thing we put into our bodies.”
İncinin Meali: “[Aşı karşıtları] aşılarla ilgili yapılan onca çalışmaya bakacak olurlarsa eğer, kanaatimce aşıların vücudumuza giren şüphesiz EN GÜVENİLİR, EN İYİ TEST EDİLMİŞ şeyler olduğunu göreceklerdir.”
Evet evet, hakikaten öyleler doktor(!)
Helsinki Bildirgesi, halihazırda “kanıtlanmış” bir tedavi yöntemi varsa güvenlik çalışmalarındaki kontrol gruplarına plasebo verilmemelidir diyor. Buradaki mantık, “onaylanmış” tedavi yerine plasebo kullanmanın kişiye hakkı olan tedavinin verilmemesi anlamına geldiğidir. O yüzden de eğer ortada “onaylı” bir tedavi varsa, “yeni” tedaviyi sadece “eskisi” veya mevcut olanla karşılaştırablilirsiniz. Ancak ben aynı mantıkla, plasebo güvenlik çalışmalarında kullanılabilmeli, ancak etkinlik çalışmalarında kullanılmamalıdır da diyebilirim?
Velhasıl, yürütülen çalışmalara ve sisteme baktığımızda herhangi bir aşının güvenli olduğuna dair bir kanıt yok ortada. Olsa olsa bu çalışmalar x aşısının “diğer” aşıdan daha güvenilir olduğunu gösteriyor, başka bir şeyi değil.
(1) http://www.fda.gov/downloads/BiologicsBloodVaccines/NewsEvents/WorkshopsMeetingsConferences/TranscriptsMinutes/UCM054459.pdf

Eyl 23, 2012 | SAĞLIK TERÖRİZMİ
Aşılar üretildi, peki ya sonra size ulaşana kadar hangi aşamalardan geçti, hiç merak ettiniz mi?
Daha üretim aşamasında kontaminasyon probleminden payını alan aşılar (1), buna rağmen paketlendi, sevkiyatı yapıldı. Nasıl taşındı; nerede, hangi ısıda ve ne kadar süreyle muhafaza edildi; son kullanım tarihi geçti mi; aşı uygulamasını yapan personel aşıyı kullanım talimatlarına uygun olarak mı çözdü, çalkaladı; aşırı sıcaklardan veya soğuk havadan aşılar nasıl etkilendi ve tabii süt dağıtamayan yetkililerin son derece hassas ve sıkı yönetmeliklere göre muhafaza edilmesi ve uygulanması gereken aşılar konusundaki basiret derecesi sizin de uykularınızı kaçırdı mı? Yoksa hiç düşünmemiş miydiniz tüm bunları?
Temel Sağlık Hizmetleri Genel Müdürlüğü’nden Dr. Hamza Özdemir 2009’un Ekim ayında güzel bir prezantasyon hazırlamış “Soğuk Zincir, Enjeksiyon Güvenliği ve Aşı Sonrası İstenmeyen Etkiler” başlıklı (http://www.asisempozyumu.org/3asisempozyumu/pdf/Hamza_Ozdemir.pdf).
Burada verilen bilgilere bakalım..
- Aşılar protein, lipid, karbohidrat ve nükleik asitten oluşan biyolojik ürünlerdir; donma ve sıcaklığın bu maddeler üzerinde olumsuz etkisi bulunur ve aşı potensini etkiler. Özel koşullarda muhafaza edilmeli, nakledilmeli ve uygulanmalıdır.
Sn. Özdemir aşıların içindeki diğer 40 çeşit maddeye (2) değinmemiş ancak yine de nakil ve saklama yöntemlerine uyulmaması sonucunda çocuğunuza hastalıktan korur diye verilen aşıların işe yaramayacağını belirtmiş.
- Isı hassasiyetleri her aşı için farklıdır. Son yıllarda aşı üretim teknolojilerinde gelişmeler aşıları ısıya daha dirençli hale getirmiştir. Isı maruziyeti kümülatiftir. Son dönemlerde tüm dünyada aşıların donması, yüksek ısıya maruziyetten daha ciddi bir problem haline gelmiştir. Donma geri dönüşümsüzdür.
- Genişletilmiş Bağışıklama Programları (GBP) başlatıldığı ve alt yapısının oluşturulduğu yıllarda aşıların nakli sırasında potenslerinin korunup korunmadığı tam olarak bilinmemekte idi. Daha sonraki 20 yıl içerisinde soğuk zincir kuralları, aşıların ısıya ve donmaya karşı hassasiyetleri ayırt edilmeksizin belirlenmiş ve uygulanmıştır. Sonuç olarak soğuk zincir çok soğuk hale gelmiştir.
İtiraflar dizisinde eksik bırakılan yerleri dolduralım. Öncelikle soralım, peki aşı üretiminde bu donma sorununa karşı ne tip önlemler geliştirilmiştir? Ya da daha doğru bir değişle, “Aşılarda antifriz etken maddesi bulunmakta mıdır?”
Bildiğimiz antifrizde (donmayı önleyici madde) etilen glikol bulunur. Etilen glikol bir bileşikler sınıfına verilen isimdir ve bu bileşiklerden biri de bazı aşılara eklenmekte olan 2-Phenoxyethanol’dur (4). Ethylene glycol phenyl ether ve ethylene glycol monophenyl ether ise 2-Phenoxyethanol ile eşanlamlıdır ve bazı aşılarda 2-Phenoxyethanol (yani, bildiğimiz antifrizdeki etilen glikolden biraz farklı bir madde olan ethylene glycol phenyl ether) bulunmaktadır.
DTaP [difteri-tetanoz-aselüler boğmaca] (Daptacel), Polio [çocuk felci] (IPV – Ipol), Tdap (Adacel) [11-64 yaş arasındaki kişiler için kullanılan Tetanoz-difteri-boğmaca aşısı] 2-Phenoxyethanol içeren aşılar arasındadır.
Nevarki, aşılardaki diğer çoğu bileşikte olduğu gibi, insan vücuduna zerk edilen bu kimyasalın da güvenli olup olmadığı büyük bir soru işaretidir. 2-Phenoxyethanol olarak bilinen bileşik veya salt ‘phenoxyethanol’ Amerikan Gıda ve İlaç Dairesi (FDA) eski müfettişlerinden Arthur M. Evangelista tarafından canlılarda gelişim sorunları ve üreme sisteminde zarara yol açan toksik bir madde olarak tanımlanmıştır(5).
Buna rağmen aşılarda antifriz kullanımı artarak devam etmekte.
2009 yılında çıkmış şu habere bakalım: “Seattle biotech develops vaccine antifreeze” (http://tdn.com/news/seattle-biotech-develops-vaccine-antifreeze/article_4dd2037a-55b4-5d84-8010-f5fc7caab3d9.html).
Yazıda şu bilgiler göze çarpıyor:
Aşıların çoğunun etkinliğini koruyabilmesi için belirli ısı aralıkları arasında kalması gerekir ve aşıların aşırı ısınıp ısınmamış veya donmuş olup olmadığını öyle bakarak anlayamazsınız.
Amerikan Centres for Disease Control and Prevention (CDC)’nin tahminlerine göre düzgün soğutma yapılmaması nedeniyle her yıl yüzbinlerce aşı zayi olmaktadır.
“Vaccine” dergisinin son baskısında [Kristensen ve PATH’daki çalışma arkadaşları] aşıları dondan korumak için gıdalarda sıkça kullanılan gliserin, propilen glikol ve polietilen glikol gibi katkı maddelerini nasıl başarıyla kullandıklarını açıklamışlardır.
Anlaşılan aşılar antifrizle koruma altına alınırken, aşıların çocuklarımızın sağlığı üzerindeki zararlarını kanıtlayan bilimsel çalışmalar kategorik ret ve inkar kalkanlarını aşamamaktadır.
PATH ve aşılardaki donma sorununu gidermek için hangi çalışmaları yaptıkları konusunda daha fazla bilgi için bkz. http://www.in-pharmatechnologist.com/Materials-Formulation/Formulation-developed-to-stop-vaccine-freeze-damage
Peki son 20 yıldır ülkemizde vurulan ve bell ki sıklıkla bu çok soğumuş soğuk zincirin mağduru olan iktidarsız aşılarla yapıldığı düşünülen bağışıklamanın istatistiksel değerleri ne kadar güvenilirdir? Gerçekten aşılamayla mı bağışıklanma sağlanmıştır yoksa hastalıklar genel yaşam koşullarının ve sanitasyonun iyileşmesiyle mi daha az görülür olmuştur? Bu soru aklımızın bir köşesinde kalsın ..
Dr. Özdemir’in sunumuna devam edelim ..
Sağlık hizmetlerinin tüm basamaklarında aşılar, ihmal nedeniyle 0°C’nin altında sıcaklığa maruz kalmaktadırlar.
- Alüminyum adjuvan tarafından adsorbe olan bir antijen içeren aşı, donma nedeniyle zarar gördüğünde, adsorbsiyon özelliğini kaybeder.
- Bu etki geri dönüşümsüzdür.
- Donma, adsorbe aşıların fiziksel yapısını değiştirmek suretiyle etki etmektedir.
- Potens dışı parametreler donmadan etkilenmemektedir.
- Sıcaklık etkisinden dolayı aşıların soğuk zincirde korunması şarttır,
- Ancak aşıların donmaya maruz kalması sıcaklıktan daha önemli bir sorundur,
- Donma, geri dönüşümsüz potens kaybına neden olur,
- Sonuçta aşı etkinliği düşer veya yok olur.
- Donma, steril apse gibi lokal yan etkilerin artmasına neden olur.
- Dünya Sağlık Örgütü (DSÖ), donma sorununa pratik uygulamada gerektiği kadar özen gösterilmediğini işaret etmektedir.
- Donmaya maruz kalmış aşıların kullanılması hedeflenen bağışıklama oranlarına ulaşmada başarısızlık nedenidir.
- Yeni ve pahalı aşıların takvime girmesiyle zayiat da önemli bir sorun olmuştur.
- Gelişmiş ülkelerde veya gelişmekte olan ülkelerde, sıcak iklimde veya ılıman iklimde yapılan çalışmalarda bir çok kez soğuk zincirin kırıldığı tespit edilmiştir.
- Sağlık çalışanları nasıl, ne sıklıkla soğuk zincirin kırıldığını ve doğurduğu sonuçları genellikle bilmemektedir.
- Son yıllarda Bakanlığımızca yapılan tüm eğitimlerde en çok donma sorunlarına dikkat çekilmektedir.
- Ülkemizde, 81 ilde aşılar soğuk odalarda, elektronik olarak ve alarm ve arızaların telefona bildirimi sistemiyle korunmaktadır.
- Dünya’da tüm aşı buzdolaplarında sürekli ısı izlemine geçilen ilk ülke Türkiye’dir.
Buraya kadar Özdemir DSÖ’nün sıcaklığın aşıların potensindeki (koruma gücündeki) olumsuz etkilerine yönelik tespitlerini aktarıyor, aşı zayiatı ve bunun ekonomik götürüsü üzerinde duruluyor ancak aşırı sıcaklık veya donmuş aşı bileşenlerinin çocukların veya genel olarak halkın sağlığına etkisinden hiç bahsedilmiyor. Sunumun bundan sonraki bölümünde de aşıların soğuk oda veya buzdolabında saklanma koşulları anlatılıyor. Ancak buraya kadar verilen bilgilerde de aklımıza takılan noktaları sıralayalım:
Öncelikle, bahsi geçen bu alüminyum adjuvanlı aşılar nelerdir?: Polio (IPV), DTaP, Tetanus/DT/Td, HPV, Hepatitis A, Hepatitis B, Hib, Pneumococcal, Anthrax
Sunumunda Sn Özdemir de şu şekilde veriyor Türkiye’de kullanılan ve “asla dondurulmaması gereken” bu aşıları: Hepatit B, DaBT-IPV (5’li karma), Konjuge Pnömokok (KPA), Td, DT, Influenza [grip], Hepatit A.
Daha önce de belirttiğimiz gibi bunların bir kısmında halihazırda insan sağlığına zararlı antifriz de kullanılmaktadır.
Hiçbir aşının koruyucu gücü %100 değildir; bu bilimsel olarak ispat edilmemiştir. O yüzden aşılanmış topluluklarda sık sık salgınlar başgöstermekte veya kişiler bazında aşının koruduğu varsayılan hastalıklara yine de yakalananlar olmaktadır. Bu durumu sadece soğuk zincirin kırılmasına bağlı bir potens düşüşüne yormak sağlıklı bir yaklaşım değildir. Bu, zaten pek işe yaramayan aşıların daha da sağlıksız yöntemlerle insanlara zerk edilerek sağlıklarının tehlikeye atılmasından başka bir şey değildir. Ancak sağlık otoriteleri güzel bir konuyu saptırma yanıltmacısıyla (red herring) aşı ısısına odaklanarak dikkati aşıların vaadedildiği gibi neden hastalıktan korumadığına dair diğer gerekçelerden uzaklaştırmaya çalışmaktadır. Bunun en yakın örneği, Amerika’da 2012 Haziran ayı başında haber olmuş bir sağlık rezaletidir.
CDC’nin Çocuklara Aşı (Vaccine for Children (VFC)) Programı, 44,000’i aşkın tedarikçisiyle birlikte programdan yararlanmaya hak kazanmış çocuklara bedava aşı sağlamaktadır. CDC’ye göre “Bu program milyonlarca çocuğun aşıya ulaşabilmesinde önemli bir rol oynamaktadır”(6). Hakikaten de Amerika’da 2010 yılında 40 milyon çocuğa toplam 3.6 milyar dolarlık 82 milyon doz aşı yapılmıştır. Amerikan Sağlık Bakanlığı Genel Müfettişliği tarafından yapılan denetleme sonucu ortaya çıkan ve medyada oldukça geniş yer bulan 52 sayfalık rapor(7) ise ebeveynlerde haklı bir endişe yaratmıştır.
Müfettişler 2010 yılının çocuklara Aşı programında en çok iş yapmış 45 aşı tedarikçisini ziyaret ediyor, aşı koordinatörleriyle görüşüyor, aşılama uygulamalarını inceliyor ve aşı depolama ünitelerindeki sıcaklık değerlerini 2 hafta süreyle ölçüyor.
Aşı tedarikçilerinin 34’ünde, yani %76‘sında, 2 haftalık süre boyunca en az 5 kümülatif saat boyunca aşı saklama sıcaklıklarının olması gereken değer aralığının ya çok üstüne çıktığı ya da fazlasıyla altına düştüğü belirleniyor. Aynı süre boyunca bu merkezlerde değeri 368,820 Dolar’ı bulan toplam 9,173 doz aşı bulunuyor.
16 tedarikçide kullanım süresi dolmuş aşı saptanıyor ve bunların 13’ü bu süresi geçmiş aşıları sağlam aşılarla beraber aşı saklama ünitesinde tutmaya devam ediyor. 2010 yılındaki Çocuklara Aşı programındaki tüm aşıların %3’ünün son kullanım tarihi geçmiş olsa, bu o yıl 2.4 milyon doz aşının zayi olduğu anlamına gelir. Üstelik bu hükümsüz aşıların çocuklara verilme ihtimali de mevcut.
http://www.cdc.gov/vaccines/pubs/pinkbook/index.html#appendices adresinden CDC’nin aşılarla ilgili kullanım ve depolama talimatlarına ulaşılabilir. Dr. Özdemir de sunumuna aktarmış bir kısmını ve açıkçası santimine kadar aşıların soğutucudan veya yerden uzaklığının, termometrenin soğutucu veya dolabın neresine konulduğun kritik önem taşıyacağı ve günde 2 kez kontrollerin yapılması gerekliliği gibi teknik konuların bırakın Türkiye’yi Amerika’da bile uygulanmadığını görünce, bu konuda Sağlık Bakanlığımızın verdiği eğitimler acaba pratiğe geçmiş midir diye merak etmeden duramıyor insan.
Sürekli +2 ila +8 derece arasında muhafaza edilmesi gereken aşılar daha yüksek ısıya maruz kaldıklarında içindeki maddelerin birbiriyele etkileşime geçmesi, dekompoze olup tortulaşma ve/veya çökelmeye yol açması beklenebileceği gibi mikrobiyal kirlenme de yaşanabilir. Bu aşıların insan sağlığına zararlı olacağı aşikardır.
Termometre kullanılıyor olması optimal sıcaklık değerlerinin sağlanmış olduğu anlamına gelmez. Okuma sırasında değerlerde artış veya düşüş gözlenebilir, ulaşılan en yüksek/en düşük sıcaklık değerini bilmek olanaksızdır, bizzat aşı şişelerinin durduğu yerin ısısını veya şişelerin iç sıcaklığını göstermiyor olabilecekleri gibi çoğu halde bu termometrelerden güvenilir ölçüm alamazsınız.
Kalibrasyonlu termometreler ulaşılan maksimum/minimum sıcaklık değerlerini gösterirler, ancak bunlarda da bu sıcaklık değerlerinde ne kadar süreyle kalınmış olduğunu göremezsiniz.
Buzdolabı iiçindeki sıcaklık ise ölçümün üst mü alt mı, dolabın arka tarafında mı yoksa kapak kısmında mı yapıldığına göre değişiklik gösterir. Dolabın içine fazlaca aşı ünitesi doldurulduğunda yine sıcaklığı etkileyecek ve dolap içi sıcaklık değeri ancak saatler sonra stabil hale gelecektir.
Aşı üreticisi ilaç firmaları normalde kullanılmamış aşıların iadesini kabul etmemektedir. Bu durum sadece olayın maddi yönünden dolayı değil, aynı zamanda aşıları iade etmek isteyen kişilerin nakliyat da dahil olmak üzere aşıların tüm zamanlarda doğru sıcaklıkta muhafaza edildiğini belgelemesinin mümkün olmamasındandır.
Amerikan sağlık yetkilileri ise düzgün şekilde muhafaza edilmemiş aşıların halen güvenli olduklarını, sadece tam korurlar mı korumazlar mı onu bilemediklerini ifade ediyorlar(8).
Bu ifadeye neresinden bakarsanız elde kalıyor, zira doğru sıcaklıkta tutulmamış aşılar sağlığa son derece zararlı hale gelebilir ve aşıların hiçbir zaman etkinliğinin %100 olmadığını kabul edersek, “yanlış sıcaklıkta tutuldu o yüzden korumadı aşılar” bahanesinin ardına bu kadar kolay sığınılamayacağı da açıktır.
Ayrıca Amerikan yetkililer, aşıların yanlış sıcaklıkta muhafaza edilmesinin aşıları daha az güvenli değil, olsa olsa daha az etkili kılacağını ifade ettikten sonra endişeye mahal olmadığını, bu durumun yaygın bir problem olmadığını, münferit vakalar olduğunu belirtiyorlar. Peki ama bunun yaygın bir problem olmadığını nereden biliyorlar?
Amerika’da durum bu, Türkiye’de acaba nasıldır ve hatta Bill Gates önderliğinde Afrika kıtasına yapılan aşılama çıkartmasında 30 farklı Afrika ülkesindeki küçük köylerde durum nasıldır? Buzdolabı bile olmayan yerleşim yerleri olduğu düşünülürse?
Türkiye’de yapılacak benzer bir denetimin sonuçlarından açıkçası korkuyorum, ancak sonuçlar her ne olursa olsun, Amerikan tipi halkla ilişkiler mekanizmasının Türkiye ağzından da aynı ifadelerin döküleceğine ve durumu bir fırsata çevireceklerine eminim. Münferit vakalar bunlar, aşılar hala güvenli, olsa olsa korumamış olabilir, o halde gelin tekrar aşılayalım sizleri ..
Sözkonusu aşılardaki alüminyum ve cıvanın (thimerosal) sinerjik etkileşimi ve doğurduğu sonuçlar ise bu makalenin konusu olmadığından bir başka yazıda ele alınacak.
(1) http://www.ncbi.nlm.nih.gov/pubmed/20456974 (“. . . However, since vaccine preparation involves the use of materials of biological origin, vaccines are subject to contamination by micro-organisms. In fact, vaccine contamination has occurred; a historical example of vaccine contamination, for example, can be found in the early days of development of the smallpox vaccine. The introduction of new techniques of vaccine virus production on cell cultures has lead to safer vaccines, but has not completely removed the risk of virus contamination. There are several examples of vaccine contamination, for example, contamination of human vaccines against poliomyelitis by SV40 virus from the use of monkey primary renal cells. Several veterinary vaccines have been contaminated by pestiviruses from foetal calf serum. These incidents have lead industry to change certain practices and regulatory authorities to develop more stringent and detailed requirements. But the increasing number of target species for vaccines, the diversity of the origin of biological materials and the extremely high number of known and unknown viruses and their constant evolution represent a challenge to vaccine producers and regulatory authorities.”)
(2) Amerikan Centres for Disease Control tarafından yayımlanmış aşı içerik listesi: http://www.cdc.gov/vaccines/pubs/pinkbook/downloads/appendices/b/excipient-table-2.pdf
(3) http://www.reference.md/files/C005/mC005398.html
(4) http://www.reference.md/files/D005/mD005026.html
(5) http://www.wnho.net/vaccine_ingredients.htm
VACCINE INGREDIENTS …AND THEIR CHEMICAL PROFILES
Compiled By Arthur M. Evangelista, a former FDA Investigator
Posted: 28 May 2004
VACCINE INGREDIENTS
Source: 1997 Physicians’ Desk Reference
Phenol : EDF Suspected – cardiovascular or blood toxicant aka Carbolic Acid – developmental toxicant, gastrointestinal or liver toxicant kidney toxicant, neurotoxicant respiratory toxicant, skin or sense organ toxicant.
More hazardous than most chemicals in 3 out of 10 ranking systems.
On at least 8 federal regulatory lists.
Phenoxyethanol: EDF Suspected – developmental toxicant, reproductive toxicant (aka: Antifreeze).
Less hazardous than most chemicals in 3 ranking systems.
(6) www.cdc.gov/media/releases/2012/s0607_children_vaccine.html
(7) http://oig.hhs.gov/oei/reports/oei-04-10-00430.pdf
(8) www.cdc.gov/media/releases/2012/s0607_children_vaccine.html
Eyl 17, 2012 | Featured, SAĞLIK TERÖRİZMİ
Aşılar, koruduğu varsayılan hastalıklar; hastalıkların özellikleri, bulaşma yolları, riskleri/tedavi yöntemleri, bunun karşısında aşılarının koruyucu güçleri, güvenlik çalışmaları ve tespit edilmiş yan etkileri konusunda araştırmanızı yaptınız ve bireysel olarak çocuğunuzun aşılanmasının gerekli olduğuna karar verdiyseniz, çocuğunuzun aşıların ciddi sağlık sorunu oluşturabilecek yan etkilerinden daha az etkilenmesini sağlayacak önlemler konusuna eğilmenizin zamanı gelmiş demektir. Bu önlemleri doktorunuzla, hatta daha iyisi güvendiğiniz birden fazla doktorla mutlaka görüşüp karşılıklı fikir alışverişinde bulunun ve aşılama ile ilgili seçeneklerin neler olduğunu öğrenin.
Aşılamadan Önce:
Araştırın. Çocukluk çağı hastalıkları ve koruyucu olarak yapılan aşılar hakkında bilgi edinin. Konu ile ilgili içinize sinecek derecede bilgi edinmeden kendinizi aşıyı yaptırtmak zorunda hissetmeyin.
Çocuğunuzun aşılanacağı dönemde hiçbir şekilde hasta olmamasına dikkat edin. Hastayken veya henüz yeni iyileşmişken aşılanması durumunda çocuğunuzun aşıya bağlı ciddi komplikasyon yaşama riski de artacaktır. Doktorunuzdan aşıyı yapmadan önce çocuğunuzun fizik muayenesini yapmasını ve herhangi bir rahatsızlığı olmadığını teyit etmesini isteyin.
Kayıt tutun. Çocuğunuzun ve ailenizin tıbbi öyküsünü gösteren belgeleri hazır edin veya yazıya dökün. Çocuğunuzun doktoruna geçirdiği belli başlı hastalıkları, varsa alerjilerini ve diğer sağlık sorunlarını özellikle de daha önce herhangi bir aşıdan sonra reaksiyon oluşmuş olup olmadığını bildirin. Aile bireylerinde herhangi bir immün sistemi rahatsızlığı veya beyinle igili bir rahatsızlık varsa belirtin. Dokümente etmek için doktorunuzdan çocuğunuza vurulan aşılarla ilgili tuttuğu kaydın bir kopyasını isteyin. Bu kayıtlarda hangi aşıların yapılmış olduğu ile birlikte aşı üreticisinin ismi ve aşının parsel numarasının da bulunmasına dikkat edin.
Soru sorun. Çocuğunuzun tıbbi öyküsünde aşıya reaksiyon gösterme riskini arttıracak herhangi bir sağlık sorunu varsa, özellikle de önceki aşılama(lar)dan sonra sağlığında bozulma yaşandıysa bunu doktorunuza bildirin. Önceki aşılamaya reaksiyon vermiş bir çocuğun müteakip aşılarda daha ağır reaksiyon yaşama riski de artacaktır. Doktorunuza mutlaka çocuğunuzda veya aile bireylerinden herhangi birinde aşı içeriğindeki yumurta, jelatin, neomycin (bir antibiyotik) veya aşının diğer bileşenlerine (doktorunuzdan, aşı prospektüsünden veya internetten aşı bileşenlerinin neler olduğunu öğrenebilirsiniz) karşı herhangi bir alerji öyküsü olup olmadığını bildirin. Doktorunuzdan yönelttiğiniz sorulara doyurucu cevap alamıyorsanız ya da sorularınız geçiştiriliyorsa mutlaka güvenilir bir başka sağlık uzmanına da danışın.
Önceden bilgi talep edin. Çocuğunuzun olması gereken aşı programındaki aşıların yararları, taşıdığı riskler ve hatta aşı sonrası görülmesi mümkğn yan etkiler hakkında doktorunuzdan yazılı bilgi isteyin ve aşılama zamanı gelmeden önce mutlaka bu bilgileri incelemiş olun. Doktorunuzdan ayrıca, aşı üreticilerinin her aşı için hazırladığı prospektüsü göstermesini de isteyebilirsiniz. Bu prospektüslerde aşının muhteviyatı, rapor edilmiş yan etkiler ve kontraendikasyon denilen, aşının geciktirilmesi veya yapılmamasını gerektirecek durumlardan bazıları belirtilmektedir. Kanunen doktorunuzun aşılama yapılmadan önce size aşının yararları ve taşıdığı riskler hakkında yazılı ve/veya sözlü bilgilendirme yapması gerektiğini unutmayın.
Grip aşısı için thimerosal içermeyen aşıları tercih edin. Çoğu çocukluk çağı aşısından çıkartılmış olsa da thimerosal çocukara öngörülen çoğu grip aşısında bulunmaktadır. Thimerosal grip aşılarının daha iyi çalışmasını sağlamaz. Bir cıva türevi olan thimerosal, daha ucuz maliyet sağlayan büyük aşı şişelerinde bakteri öldürücü olarak kullanılır. Eğer kendiniz veya çocuğunuza grip aşısı yaptırmayı düşünüyorsanız, tek dozluk, thimerosal içermeyen grip aşılarından talep edin.
Alternatif bir aşı çizelgesi takip edebileceğinizi düşünün. Yurtdışında ve ülkemizde bebek ve çocuklara tek ziyarette 2 veya daha fazla aşının aynı anda uygulanması yaygın eğilimken, kimi doktorlar da çocuklara önerilen aşıları daha geniş bir zamana yayarak, iki aşı uygulamasının arasını mümkün olduğunca açmaya çalışmaktadırlar. Doktorunuzla görüşüp çocuğunuza aynı gün içerisinde daha az aşı vurulması yönünde ortak karar alabilirsiniz. Dünyada azımsanamayacak sayıda doktor bu yolun çocuğun immün sistemine daha az yük bindireceği görüşündedir. Aşıları teker teker olduğunuz takdirde bu sizin çocuğunuzda hangi aşı sonrası bir reaksiyon oluştuğunu (şayet olursa) tespit edebilmenizi de sağlayacaktır. Küçük bebekleriniz ek gıdaya geçtiğinde herhangi bir gıdaya alerjisi olup olmadığını anlamak için bile pediyatristlerin her yeni gıdayı teker teker çocuğunuza yedirmenizi ve gözlemlemenizi tavsiye ettiğini hatırlayın.
Aşılama Sonrasında:
Her aşıdan sonra, yan etki olup olmadığını takip edin. Aşılanmadan sonraki 72 saat süresince çocuğunuzda aşıya bağlı olarak gelişmiş olabilecek alışılmışın dışında herhangi bir belirti veya davranış değişikliği olup olmadığını gözlemleyin. Aşı reaksiyonları uygulamadan 4 hafta sonrasında bile ortaya çıkabilmektedir.
Aşıya reaksiyon aşağıdaki belirtilerden bir veya daha fazlasını kapsayabilir:
- kızarık deri lekelenmesi
- ürtiker (kurdeşen)
- kaşıntı
- enjeksiyon yerinde şişkinlik, kızarıklık ve ağrı
- yüksek ateş
- solunum zorluğu veya nefes alıp vermeden hırltı, hışırtı
- ciltte veya dudaklarda solgunluk veya renk değişimi
- kaslarda zayıflama veya güçsüzlük
- aşırı uyku hali veya uyarıcıya yanıt vermeme
- hızlı kalp atışı
- sersemlik
- olağanın dışında huysuzluk, huzursuzluk veya başka davranış değişiklikleri
- uzun süreli ağlama (özellikle bebeklerde görülen çığlık şeklinde olanı)
- havale nöbetleri, konvülsiyon
- kusma veya ishal
Bu belirtilerden herhangi biri veya sizi endişelendirecek herhangi başka bir belirti oluşması durumunda derhal doktora başvurun.
Çocuğunuzun aşı sonrası ciddi bir sağlık problemi yaşaması durumunda doktorunuzdan bunu mutlaka ASİE sistemine bildirmedsini talep edin. Sağlık Bakanlığı’nın yayımladığı genelge uyarınca doktorunuzun bunu bildirme zorunluluğu olduğunu unutmayın, eğer bildirim yapılmıyorsa aynı sisteme siz de bildirimde bulunabilirsiniz..
İstanbul Üniversitesi Çocuk Sağlığı Enstitüsü, İstanbul Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı’nda görevli Prof. Dr. Gülbin Gökçay’ın hazırladığı “Kritik hastalıklardan korunma: Aşılar ve yan etkileri” adlı sunumda (http://www.cayd.org.tr/Egitim/yeni%20asilar%20ve%20asie.pdf) ASİE bildirim sistemine rapor edilmesi gereken reaksiyon ve bulgular şu şekilde verilmiştir:
| Lokal reaksiyonlar |
Sinir Sistemi ile İlgili İstenmeyen Etkiler bildirim |
Diğer İstenmeyen Etkiler |
- Aşıdan sonra 48 saat içinde ciddi lokal reaksiyon (1)
- Aşıdan sonra 7 gün içinde enjeksiyon yerinde abse (2)
- Aşıdan sonra 2 hafta – 6 ay içinde lenfadenit (3)
|
- OPA’dan sonra 4-30 gün (temaslılarda 4 -75 gün) içinde ortaya çıkan paralitik poliomiyelit (4)
- Kızamık bileşenli aşıları takiben 5-12 gün, DaBT-IPA-Hib aşısını takiben 72 saat içinde konvülsiyon (5)
- Kızamık bileşenli aşıları takiben 5-15 gün içinde ortaya çıkan ensefalopati (6)/ensefalit (7)
- DaBT-IPA-Hib aşısını takiben 72 saat içinde ortaya çıkan ensefalopati
- Tetanoz bileşenli aşılardan sonra 2-28 gün içinde ortaya çıkan brakial nevrit (8)
- Aşıdan sonra 0-6 hafta içinde ortaya çıkan paraliziler (9)
- Kabakulak bileşenli aşıları takiben 15-21 gün içinde ortaya çıkan aseptik menenjit (10)
|
- Aşıdan sonra 1 saat içinde ortaya çıkan anaflaksi (11)
- Aşıdan sonra birkaç saat içinde ortaya çıkan toksik şok sendromu (12)
- Aşıdan sonra 4 saat içinde ortaya çıkan (deri bulguları daha geç görülebilir) akut alerjik reaksiyonlar (13)
- DaBT-IPA-Hib aşısından sonra 24 saat içinde ortaya çıkan hipotonik-hiporesponsif atak (14)
- Aşıdan sonra 1 hafta içinde ortaya çıkan sepsis (15)
- Kızamıkçık aşısından sonra 1-3 hafta içinde artrit (16)
- Kızamık aşısından sonra 1-6 hafta içinde gelişen trombositopeni (17)
- DaBT-IPA-Hib aşısından sonra 24 saat içinde gelişen apne – bradikardi (18)
- BCG aşısından sonra 1 – 12 ay içinde gelişen yaygın BCG enfeksiyonu ya da BCG osteiti (19)
- Zaman sınırı olmaksızın yukarıdakiler dışında sağlık personeli ya da toplum tarafından aşılamayla ilgisi olduğu düşünülen, ciddi kaygı ya da olumsuz propaganda nedeni olan durumlar
|
(1) Ciddi Lokal Reaksiyon: Enjeksiyon alanında ve çevresinde ilk 48 saat içinde oluşan hiperemi (kızarıklık) ve/veya ödem ile birlikte aşağıdakilerden en az ikisinin varlığı ciddi lokal reaksiyon olarak bildirilmelidir.
- Yakın eklemi içine alacak şekilde yayılmış olan şişlik, ödem
- Ağrı, şişlik, kızarıklığın üç gün veya daha uzun sürmesi,
- Hastaneye yatışı gerektirmesi.
(2) Abse: Enjeksiyon yerinde 2- 7 gün içinde ortaya çıkan, içi sıvı dolu sert veya fluktuasyon veren kolleksiyon varlığında enjeksiyon yerinde abse oluşumu olarak kabul edilmeli, boyutları ile birlikte bildirimi yapılmalıdır.
- Eğer, ateş, pürülan sıvı, kızarıklık-endürasyon, hassasiyet, kültür pozitifliği gibi enfeksiyon bulguları mevcutsa pürülan (bakteriel) abse,
- Eğer enfeksiyon bulguları olmadan sadece lokal abse bulguları mevcutsa steril abse olarak değerlendirilmelidir.
(3) Lenfadenit:
- En az bir lenf bezinin 1.5cm ya da üzerinde büyümesi ve/veya,
- Bir lenf bezinin üzerinde drene olmuş sinüs varlığıdır.
Genellikle BCG’nin neden olduğu bir durumdur. Aşı uygulandıktan sonraki 2 hafta ile 6 ay içinde, aşının uygulandığı tarafta boyun ya da koltukaltı lenf bezlerinde ortaya çıkar.
(4, 8, 9) Akut Paralizi [Felç]
- Aşıya Bağlı Paralitik Poliomyelit: OPA [Oral Polio Vaccine/ Ağızdan Uygulamalı Çocuk Felci Aşısı] aşısı uygulanmasından sonraki 4-30 gün (temaslılarda 4-75 gün) içinde akut olarak flask paralizi (gevşek felç) gelişmesi, başlangıç tarihinden itibaren 60 gün sonrasında kalıcı nörolojik sekel ya da ölüm olmasıdır. Kesin tanı için paralizi yapan diğer nedenlerin olmadığının kanıtlanması gereklidir.
- Brakial Nevrit: Tetanos komponentli aşıların uygulanmasından sonraki 2-28 gün içinde, aşı uygulanan tarafta, karşı tarafta ya da her iki tarafta üst ekstremitede omuz ve üst kolu tutan, derin, sürekli ve ciddi ağrı ile karakterize bir klinik tablodur. Ağrıyı günler ve haftalar içinde üst ekstremite kas gruplarında güçsüzlük ve atrofi takip eder. Daha az sıklıkla tabloya duyu kaybı eşlik edebilir. Tanıda güçsüzlüğün saptanması gereklidir.
- Diğer paraliziler:Aşı uygulamasından sonra 0-6 hafta içinde görülen paraliziler bu grupta yer almaktadır.
(5) Nöbet Geçirme (Konvülsiyon) (febril/afebril): Fokal nörolojik bulgular eşlik etmeden havale geçirilmesi bildirilmelidir. Koltukaltından ölçülen vücut sıcaklığı 38 0C ve üzerinde ise febril konvülsiyon, ateş yoksa afebril konvülsiyon olarak değerlendirilmelidir.
Kızamık aşısı sonrası konvülsiyon 5 -12 gün içinde, DaBT bileşenini içeren aşılar ile KPA aşısını takiben 72 saat içinde ortaya çıkabilir.
[ed-Not: Ateşli havale; beyin hücrelerinin normal dışı bir aktivite göstermesi sonucu ortaya çıkan, vücuttaki istemsiz kasılmalardır.]
(6) Ensefalopati [Beyin iltihabı]: Aşağıda belirtilen üç durumdan ikisinin varlığı ile tanımlanır. Kızamık komponenti içeren aşıların uygulanmasını takiben 5-15 gün içinde, boğmaca komponenti içeren aşıların uygulanmasını takiben 7 gün içinde ise aşı ile ilişkili olduğu düşünülmelidir.
- Nöbet geçirme,
- Bir gün veya daha uzun süren bilinç değişikliği,
- Bir gün veya daha uzun süren davranış veya kişilik değişikliği
(7) Ensefalit: Ensefalit tanısı yukarıda sıralanan belirtilere ek olarak beyin omurilik sıvısı (BOS)’da pozitif bulguların (hücre artışı, mikroorganizma ya da antijeninin) gösterilmesi ve/veya virüs izolasyonu ile konur.
(10) Aseptik Menenjit: Kabakulak aşısı ile ilgili aseptik menenjit, sıklıkla aşılamadan 15-21 gün sonra görülür. Menenjit belirti ve bulguları vardır. BOS’da bakteri yoktur ve lenfosit hakimiyeti (>5 lenfosit/ml) ile karakterize pleositoz vardır. Kesin tanı aşağıdakilerden en az birinin saptanması ile konur;
- BOS’dan kabakulak virusu izolasyonu, ya da
- BOS’dan kabakulak virusu izolasyonu ve sekanslama ile aşı virusu saptanması.
(11) Anafilaksi: Genellikle aşı uygulandıktan sonra ilk bir saat içerisinde gelişen dolaşım bozukluğuna (bilinç bulanıklığı, düşük kan basıncı, periferal nabızların yokluğu ya da güçsüzlüğü, periferal dolaşım bozukluğuna bağlı ekstremite soğukluğu, yüzde kızarıklık ve terlemede artma) neden olan akut allerjik reaksiyonların ağır/ciddi formudur. Yaygın ürtiker, anjioödem ve bronkospazm, laringospazm sıklıkla klinik tabloya eşlik eder ancak gerek bronkospazm (nefes darlığının ön planda olduğu semptom ve bulgular) gerekse laringospazm (solunum açlığı, nefes alamama şeklinde gelişen semptom ve bulgular) gelişmeden de dolaşım yetmezliği (kardiyak ve vasküler fonksiyon bozukluğu) ve şok gelişebilir.
(12) Toksik Şok Sendromu: Aşı uygulanmasını takip eden bir kaç saat içerisinde kusma, ishal ve yüksek ateş gelişimi ile ortaya çıkabilen diffüz eritem, ateş, hipotansiyon, deskuamasyon ve organ yetmezliği tablosudur. Staphylococcus aureus toksinine bağlı olarak, daha az sıklıkla Streptococcus pyogenes pirojenik toksinine bağlı olarak da gelişebilir.
(13) Akut Alerjik Reaksiyonlar: Kesin sınırlaması olmamakla birlikte; aşılama sonrasında allerjik sorunlar dakika ve saatler içinde sıklıkla ilk dört saat içerisinde görülür. Deri bulguları daha geç ortaya çıkabilir. Klinik tablo aşağıdakilerden bir veya daha fazlasının varlığı ile karakterizedir.
- Lokal olarak kızarma, kabarma veya aşı yapılan yerde lokalize ürtikerden geniş ürtiker alanlarına, enjeksiyon yapılan ekstremitede ödem, yüz ödemi veya tüm vücutta ödeme kadar değişen tablo
- Bronkospazm (nefes darlığı, solunum sıkıntısı, hışırtılı nefes alıp verme),
- Laringospzam/laringeal ödem (solunum açlığı vardır, soluk alıp vermeye çalışır ancak akciğerlere yeterli hava gitmez, konuşamaz).
(14) Hipotonik-Hiporesponsif Atak: Aşıdan sonra 24 saat içinde birden bire ortaya çıkan solukluk, uyaranlara azalmış ya da kaybolmuş cevap, kas tonusunda azalma ya da kaybolmadır. Atak kendiliğinden geçer.
(15) Sepsis: Aşıdan sonraki ilk 1 hafta içinde gelişen, generalize, organ yetmezliği ve dolaşım bozukluğunun eşlik edebileceği, sıklıkla ateşin bulunduğu ancak hipoterminin de gelişebileceği taşikardinin ve takipnenin tespit edildiği klinik tablodur. Kan kültüründe bakteriyel etken tespit edilebilir ancak bu her zaman mümkün olmayabilir. Genellikle uygulama hatasına bağlı olarak ortaya çıkar.
[ed-Not: Sepsis bir mikrobun kanda, vücut sıvılarında veya dokularda çoğalması sonucunda vücutta oluşan hastalık ve hasar halidir. Sepsis bakteri, virus ve mantar gibi farklı mikrop türleri ile gelişebilir. Mikrop kan veya komşuluk yoluyla birden fazla organa yayılarak organların normal fonksiyonlarını bozar, hastalık zamanında ve uygun şekilde tedavi edilmezse şok ve ölümle sonuçlanır.]
(16) Artrit: Kızamıkçık aşısından sonra 1-3 hafta içinde başlayan eklemlerde (sıklıkla proksimal interfalangiyal ve metakarpofalangiyal eklemler, diz, ayak bileği ve ayak parmakları) efüzyon veya şişlik, ısı artışı, hassasiyet, hareketle ağrı veya hareket kısıtlılığı semptomlarından en az ikisinin olması durumudur.
(17) Trombositopeni: Tam kan sayımında trombosit sayısının 50.000’in altında oluşudur. Kızamık aşısı uygulanmasından sonraki 1-6 hafta içinde ortaya çıkabilir. Klinikte purpura veya hafif travma sonrası kanamalar ve morluklarla karakterizedir
[ed-Not: Trombositopeni kanınızda platelet adı verilen hücre parçacıklarının normalden daha az sayıda bulunması durumudur. Plateletler kemik iliğinizde diğer kan hücreleriyle birlikte yapılırlar. Plateletler kanda hareket ederler ve bir kan damarı hasar gördüğünde oluşabilecek kanamayı durdurmak için birbirlerine yapışarak pıhtı oluştururlar. Plateletlere aynı zamanda trombosit adı da verilir, çünkü kan pıhtısına trombus da denir. Kanınızda çok az platelet varsa hafif ya da ciddi kanamalar oluşabilir. Bu kanama vücut içine (iç kanama) ya da derinin altında veya deriden dışarı (dış kanama) şeklinde olabilir. Trombositopeni, özellikle kanama şiddetliyse veya beyinde oluşursa ölümcül olabilir. Ancak, genelde trombositopenili kişilerde düşük platelet sayımının nedeni bulunur ve tedavi edilirse genel gidişat iyidir.]
(18) Apne – Bradikardi: DaBT-İPA-Hib aşısından sonra prematüre bebeklerde, 24 saat içinde apne-bradikardi olması durumudur.
[ed-Not: Apne terminolojik olarak 20 saniye ve üzeri solunum durmasıdır. <span >Bradikardi (KTA < 100/dlk) ile birliktedir ve apne süresi uzadıkça solukluk, hipotansiyon ortaya çıkar, taktil stimülasyona cevap alınamaz. Apne bulgusu olan yenidoğanda, gestasyon yaşı ve apnenin ortaya çıktığı postnatal yaş önemlidir].
(19) Yaygın BCG Enfeksiyonu: BCG aşılamasından sonra genellikle 1 -12 aylık dönemde ortaya çıkan ve Mycobacterium bovis BCG suşunun izole edilerek doğrulandığı dissemine enfeksiyondur.
[ed-Not: “Nadir ve ölümcül seyredebilen bir komplikasyon olan yaygın BCG enfeksiyonu (BCGitis) özellikle immünsupresif hastalarda BCG uygulaması sonrasında birkaç hafta içinde gelişebilir. Karaciğer fonksiyon bozukluğu, pansitopeni; karaciğerde, lenf nodlarında, akciğerde, kemik iliğinde, dalakta BCG pozitif granülomlar ile karakterize oldukça ciddi bir tablodur (2).”, bkz. http://www.uroonkoloji.org/ebulten/pdf/pdf_URO_326.pdf]
BCG Osteiti: BCG aşısının (aşı uygulamasından 1 -12 ay içinde ortaya çıkabilen) neden olduğu tüm uzun kemikleri tutabilen kemik inflamasyonudur.
Bu yan etki ilstesinin, şu anda Türkiye’de çocukluk aşıları takviminde yer alan Hepatit B, Hepatit A, su çiçeği, zatürre aşısı olarak da bilinen konjüge pnömokok (KPA) gibi aşıların bilinen yan etkilerini içermediği dikkate alınmalıdır.
Kaynak: Sağlık Bakanlığı, Ek 2, Vaka Tanımları Belgesi (http://www.saglik.gov.tr/TR/dosya/1-44884/h/ek-2-vaka-tanimlari.doc)
İstanbul’da ASIE Bildirimleri için:
İSTANBUL İL SAĞLIK MÜDÜRLÜĞÜ
BULAŞICI HASTALIKLAR ŞUBESİ
TEL: 0212 5118920-22/1412-14
Eyl 16, 2012 | SAĞLIK TERÖRİZMİ
“Aşılama Programlarının Felsefesi ve Aydınlatılmış Onam” adlı yazıda aşılama öncesi kendinize sormanız gereken soruları vermiştim. Şimdi bu sorulara vereceğiniz evet ya da hayır cevabının ne anlama geleceğine bakalım. 1986 yılında Amerika Birleşik Devletleri Kongresi ile birlikte çalışarak Ulusal Çocukluk Çağı Aşıları Maluliyet Yasası’nın çıkmasına katkıda bulunan NVIC (National Vaccine Information Centre) kurucusu Barbara Loe-Fisher’ın önerileri şu yöndedir: Aşılanmaya karar verdiğiniz takdirde mutlaka sizin veya çocuğunuzun olduğu aşılar ve dozlarını, aşıyı üreten firma ve aşı parsel numarası da dahil olmak üzere yazılı olarak kaydedin. Aşılanma sonrası oluşan ciddi sağlık problemleri detaylı bir şekilde yazıya geçirin ve aşılanma kayıtlarınızı elinizin altında bulundurun. Ülkemizde de tıpkı Amerika ve diğer gelişmiş ülkelerde olduğu gibi, 2003 yılından beri programa alınan aşılar sonrası oluşacak istenmeyen etkilerin takibi için AŞI SONRASI İSTENMEYEN ETKİ İZLEME (ASİE) SİSTEMİ bulunmaktadır (http://www.asm.gov.tr/UserFiles/File/bulasici/ASIE2009GENELGESI.pdf). Sağlık Bakanlığı’nın yayımladığı genelgeye göre [metin içi vurgular bana aittir]: Aşı Sonrası İstenmeyen Etki (ASİE): Aşı uygulanan bir kişide, aşı sonrası ortaya çıkan, bilinen aşı yan etkisi ya da aşıya bağlı olduğu düşünülen herhangi bir istenmeyen tıbbi olaydır.
ASİE izleme sisteminin temel amacı; aşılama hizmetinin kalitesini iyileştirmek ve aşılamanın kabul edilebilirliğini arttırmaktır. Bu amaca ulaşmada uygulanacak stratejiler;
- Meydana gelen istenmeyen olguları düzenli olarak izlemek, analiz etmek ve yorumlamak,
- Ciddi istenmeyen etkiler görüldüğünde bunların aşıya bağlı olup olmadığını ortaya koymak,
- Program uygulama hatalarına neden olan sorunlara müdahale etmek,
- Aşı yan etkilerinde beklenenin üzerinde bir yükseliş görülürse müdahale etmek,
- Müdahaleler ve uygun iletişim kanalları ile halkın aşılama programına güvenini sağlamak olarak belirlenmiştir.
AŞI SONRASI İSTENMEYEN ETKİLERİN SAPTANMASI VE BİLDİRİMİ
ASİE bildirimi;
- Aşılama çalışmalarında görev alan sağlık personeli,
- Sağlık kuruluşlarında çalışan sağlık personeli,
- Aileler ve toplumun diğer üyeleri tarafından yapılabilir.
Güvenlik ve etkinlik çalışmaları ülkemizde yapılmamış, dünyanın başka herhangi bir nüfus grubunda [üstelik de sayıca oldukça küçük gruplar üzerinde] denenip, ilaç firmalarının evet ürünümüzü test ettik, güvenlidir ve etkilidir [korur] diyerek lisansını aldıkları aşıların gerçekten Türkiye popülasyonu ve özelde de bizzat sizin çocuğunuz için gerçekten güvenli ve etkili olup olmadığının anlaşılması için ortaya çıkan istenmeyen yan etkilerin devlet kanallarınca mutlak surette izlemesi, bunun için de bizlerin gerekirse doktorumuzu ASİE sistemini kullanması yönünde uyarmamız, olumlu sonuç alamıyorsak da bizzat kendimiz rapor etmemiz gerekmektedir (1).
ASİE ve benzeri sistemler dünyada aslına bakılacak olursa, laboratuvar ve klinik deneyler sonrasında onay verilerek piyasaya sürülen ilacın (aşının da bir ilaç olduğu unutulmamalıdır) genel halk üzerinde denenerek bir nevi pazarlama sonrası araştırmasının yapılmasından başka bir şey değildir (2). Bu durumda devlet birimlerinin programa aldıkları aşılar aslen sizin çocuğunuz üzerinde denenmiş, yani çocuğunuz bir deney kobayı olarak kullanılmış olmaktadır. Aynı şekilde devletin denetim birimlerince onaylanmış, ancak piyasaya sürüldükten sonra yaşanan ağır yan etkiler ve hatta ölümler sonucunda toplatılmak suretiyle piyasadan çekilmiş kaç ilaç ve aşı olduğu düşünülürse sanırım herhangi bir kurum tarafından verilen güvence her ne olursa olsun anne-baba olarak bu tip bir tıbbi uygulamaya neden ihtiyatlı yaklaşmamız gerektiği anlaşılacaktır.
Bu yüzden de kendimizde veya çocuğumuzda aşı sonrası oluşacak istenmeyen etkileri tanıyabilmemiz, buna bağlı olarak gerekli tıbbi bakımı talep edebilmemiz ve devletin aşıların lisans sonrası yan etkilerini takip eden birimlerini ASİE sistemi kanalıyla bilgilendirmemiz gerekmektedir. Bu şekilde devlet birimlerini, aşılardan zarar görebilecek kişi ve grupların taşıdıkları yüksek risk faktörleri konusunda da bilgilendirmiş olmaktayız.
Eğer sizde veya çocuğunuzda, aşılamayı takip eden saatlerde, gün veya haftalarda aşağıdaki semptomlar ortaya çıktıysa ASİE sistemine bildirilmelidir. Aşı reaksiyonu belirtilerinden bazıları şunlardır:
- İğne yerinde belirgin şişlik, kızarıklık, yanma veya sertlik;
- Vücutta kırmızı döküntü veya üritker;
- Şok/birden yere yığılma;
- Çığlık şeklinde ağlama veya saatler süren, teskin edilemeyen ağlama;
- Aşırı uyku hali veya uyarıcılara uzun süreli tepkisiz kalma;
- Yüksek ateş (39 derece ve üstü);
- Vücut, kol, bacak veya başta istemdışı irkilme ve kasılmalar;
- Gözde kayma/şaşılık oluşumu;
- Vücudun herhangi bir bölümünde güçsüzlük veya paralizi;
- Göz teması kurmama, çevresinde olup bitene tepki vermeme veya sosyal anlamda içine kapanma;
- Bebeklerde yüzüstü veya sırtüstü dönme, oturma veya ayakta durmada kabiliyet kaybı;
- Görme veya işitme duyusu kaybı;
- Huzursuzluk, hiperaktivite veya konsantrasyon sorunu;
- Sahip olunan uyku/uyanıklık düzeninde değişikliğe yol açacak sekilde görülen uyku bozukluğu;
- Baş vurma veya tekrarlı hareketler yapmaya başlama (el çırpma, yerinde sallanma, dönme);
- Eklem ağrısı;
- Kas güçsüzlüğü;
- Aşırı halsizlik, çöküntü;
- Hafıza kaybı;
- Kronik kulak iltihabı veya solunum yolları enfeksiyonu başlangıcı;
- Çok şiddetli veya aralıksız devam eden ishal veya kronik kabızlık;
- Nefes darlığı (astım);
- Fazla kanama (trombosit düşüklüğü) veya kansızlık (anemi).
13.03.2009 tarihli T.C. Sağlık Bakanlığı Aşı Sonrası İstenmeyen Etkiler (ASİE) Genelgesi’ne göre Türkiye’de uygulanan aşılama programı sonucu oluştuğu gözlemlenmiş yan etkiler, ciddiyet derecesi ve nedenleri şunlardır:
1. AŞI SONRASI İSTENMEYEN ETKİLER VE NEDENLERİ
ASİE’ler bazı vakalarda aşının kendisine, bazılarında ise aşının uygulanması sırasındaki hatalara bağlı olabileceği gibi, aşı ya da uygulama ile ilgisiz de olabilir.
Bu nedenle ASİE’ler beş grupta toplanmaktadır:
- Aşı yan etkisi
- Program uygulama hataları (aşının üretim, dağıtım ve uygulanması sırasında ortaya çıkabilecek hatalar)
- Enjeksiyon reaksiyonu
- Rastlantısal
- Bilinmeyen
1.1. Aşı Yan Etkisi
Aşılar yıllardır bulaşıcı hastalıkları önlemek için kullanılmakta ve çok güvenilir oldukları bilinmektedir. Aşının kendi özelliklerine ve bileşenlerine bağlı olarak ortaya çıkan yan etkiler genellikle hafiftir. Ciddi yan etkiler ise oldukça nadir görülmektedir.
Ciddi ASİE: Ölüm, sakatlık, konjenital anomali ile sonuçlanan veya hastanede yatış gerektiren ASİE’dir.
GBP kapsamında yer alan aşıların yan etkileri ve yaklaşım önerileri Tablo 1 ve Tablo 2’de özetlenmiştir.
Tablo 1. Sık Görülen, Hafif Yan Etkiler ve Yaklaşım Önerileri
| Aşı |
Lokal reaksiyona
(ağrı, şişlik, kızarıklık) |
38 oC’yi geçen ateş b |
Huzursuzluk, kırgınlık ve sistemik belirtiler c |
| BCG |
% 90- 95 |
|
|
| DaBT-IPA-Hib |
% 20-40 |
% 3-5 |
% 20-40 |
| Td /DT/TT |
~ %10* |
~ %10 |
~ %25 |
| OPA |
|
<%1 |
< %1** |
| Hepatit-B |
erişkinde %15,
çocukta % 5 |
|
%1-6 |
| KKK*** |
%10 |
%5-15 |
%5 döküntü, <%1 artralji, <%1 lenfadenopati, <%1-5 parotit |
| Hib |
% 5-15 |
%2-10 |
|
| KPA |
%10-20 |
%10-20**** |
%10-20 |
| DaBT: Difteri, Aselüler boğmaca, Tetanoz Aşısı |
OPA: Oral Polio Aşısı |
| Td: Erişkin Tipi Difteri-Tetanoz Aşısı |
İPA: İnaktif Polio Aşısı |
| DT: Çocuk Tipi Difteri-Tetanoz Aşısı |
KKK: Kızamık, Kızamıkçık, Kabakulak Aşısı |
| Hib: Hemofilus Influenza tip b Aşısı |
KPA: Konjuge Pnömokok Aşısı |
- a Aşı yerine soğuk uygulama, parasetamol
- b Ekstra sıvı verme, ılık pansuman uygulama, parasetamol
- c Ekstra sıvı verme, parasetamol
- *Lokal reaksiyonlar rapel dozlarda %50-85’e kadar çıkabilir.
- ** Sistemik belirtiler ishal, başağrısı ve/veya kas ağrısı, uyku hali, iştahsızlık şeklinde olabilir.
- *** Kızamıkçık aşılamasını takiben en sık görülen ASİE’ler; ateş, lenfadenopati, döküntü, boğaz ve baş ağrısı şeklinde hafif kızamıkçık tablosu ve artraljidir. Artrit ve artralji yalnızca duyarlı kişilerde daha yaygın olarak yetişkinlerde özellikle kadınlarda gözlenir. Artralji çocuklarda <% 1 görülürken adolesan ve yetişkin kadınlarda %25 sıklıkta görülmektedir. Kullanılan kabakulak suşuna bağlı değişen sıklıklarda parotit görülebilir.
- ****Ateş sıklığı, prematürelerde ve düşük doğum ağırlıklı bebeklerde zamanında doğan bebeklere göre daha fazla olup çoğu zaman 39ºC üzerindedir.
Tablo 2. Nadir Görülen, Ciddi Yan Etkiler
Aşı
|
Reaksiyon
|
Ortaya çıkış süresi
|
1 milyon dozda görülme sıklığı
|
| BCG |
- Lenfadenit
- BCG Osteiti
- Yaygın BCG enfeksiyonu
|
- 2 hafta -6 ay
- 1-12 ay
- 1-12 ay
|
|
| DaBT-IPA-Hib₣ |
- 3 saatten fazla süren çığlık tarzında durdurulamayan ağlama
- Konvülsiyon
- Hipotonik hiporesponsif atak
- Anaflaksi
- Ensefalopati
- Apne – Bradikardi₤
|
- 0-24 saat
- 0-72 saat
- 0-24 saat
- 0-1 saat
- 0-7 gün
- 0-24 saat
|
- 0-4800
- 0-290
- 0-470
- 0-1
- 0-1
|
| DaBT,Td/DT/ TT (Tetanoz bileşenine bağlı) |
- Brakial nevrit
- Anaflaksi
- Steril apse
- Ciddi lokal reaksiyonδ
|
- 2-28 gün
- 0-1 saat
- 1-6 hafta
- 0-2 gün
|
|
| OPA |
- Aşıya bağlı paralitik poliomyelit
(risk ilk dozda, erişkinlerde ve immün yetmezliği olanlarda daha yüksektir). |
- 4-30 gün
- (temaslılarda 4-75 gün)
|
- 0.70 (ilk doz)
- 0.11-0.16 (sonraki dozlarda)
- 0.13 (temaslılarda)
|
| Hepatit-B |
|
|
|
| KKK (Kızamık1,&, Kabakulak2 ve Kızamıkçık3 bileşenine bağlı) |
- Febril konvülsiyon1
- Trombositopeni1
- Anaflaksi1,3
- Ensefalopati/Ensefalit1
- Aseptik menenjit2
- Artrit3
|
- 5-12 gün
- 1-6 hafta
- 0-1 saat
- 5-15 gün
- 15-21 gün
- 1-3 hafta
|
- 333
- 33
- 0-1
- 0-1
- 1-1000Ω
- Çocuklarda nadir, ancak adolesan ve kadınlarda 100. 000
|
| Hib |
Bildirimi yoktur |
|
|
| KPA |
Konvülsiyon |
0-72 saat |
Nadir |
- ₣ Ağırlıklı olarak DaBT bileşenine bağlıdır.
- ₤Prematüre bebeklerde görülebilir.
- δÖzellikle çok sayıda pekiştirme dozu alanlarda bildirilmiştir.
- Ω Kullanılan aşı suşuna bağlı olarak görülme sıklığı değişmektedir.
- & KKK aşısı antijenlerine ve reaksiyonlara verilmiş olan üst numaralar antijene özel aşı yan etkisini göstermektedir.
ASİE sistemi ile ilgili sorunları ayrı bir bölümde ele alacağız, ancak bilinmelidir ki bu tablolarda ve yukarıda Amerika’da yaygın olarak görülen aşı yan etkilerinden başka semptomlar da olabilir. Aşı sonrası her istenmeyen etki aşıyla alakalı olmayabilir, ancak bu doktorların aşılama sonrası ortaya çıktığı klinik olarak gözlemlenmiş semptomları otomatik olarak ‘aşı yapmaz’ (rastlantısal, bilinmeyen) diye savuşturabileceği anlamına da gelmemektedir. Bu yüzden de doktorunuz aşılama sonrası oluşmuş hertürlü ciddi sağlık probleminin kalıcı kaydını tutmalı, ayrıca aşılama sonrası siz veya çocuğunuzun fiziksel, zihinsel veya duygusal yapınızda önemli değişikliğe yol açmış ciddi bulguları ASİE sistemine bildirmelidir.
Bunun yanında bir diğer önemli nokta da, aşılama(lar) sonrası yaşanan sağlık probleminin aşı ile nedensel bir bağlantısı olmadığı saptanana dek kişiye tekrar aşı yapılmaması gerekliliğidir. Kişinin sağlığında ciddi anlamda bozulma yaşanırken yapılacak ek aşılama kişinin sakatlanmasına veya ölümüne yol açabilir. Bu konu da ilerleyen bölümlerde “challenge”, “dechallenge” , “rechallenge” ilkesi altında açıklanacaktır.
(1) http://www.fda.gov/NewsEvents/Testimony/ucm115058.htm “[VAERS] is especially valuable in assessing the safety of newly marketed vaccines. Careful review of reports during the initial months following licensure can provide additional assurance about the safety of a new vaccine, uncover previously unexpected events which occur when a vaccine is used in a more diverse population than was studied in clinical trials or rapidly identify potential problems not observed pre-licensure.“
(2) ibid. [. . . “It is similar in intent and operation to surveillance systems for other types of FDA regulated products maintained by the FDA and to safety surveillance programs in other countries.” . . . “These types of systems are essential to the discovery of potential rare adverse consequences of medical products that may not become evident until millions of people have been exposed to them. While they are critical to FDA’s post-marketing surveillance, there are important limitations to the interpretation of the data, however, as discussed below.”]